
分析 n (CO2)=0.2mol,n(NaOH)=0.3mol,
则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,
则有:2>$\frac{n(NaOH)}{n(C{O}_{2})}$=$\frac{3}{2}$>1,
所以:所得产物为Na2CO3和NaHCO3,
设所得产物中含Na2CO3为xmol,NaHCO3为ymol,
则得方程组:x+y=0.2,2x+y=03,解得:x=0.1,y=0.1,
在含等物质的量的碳酸钠、碳酸氢钠的溶液中,碳酸根离子水解大于碳酸氢根离子的水解,水解使溶液显碱性,根据溶液中的三大守恒来来解答.
解答 解:(1)n (CO2)=0.2mol,n(NaOH)=0.3mol,则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,
则有:2>$\frac{n(NaOH)}{n(C{O}_{2})}$=$\frac{3}{2}$>1,所以:所得产物为Na2CO3和NaHCO3,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,则得方程组:x+y=0.2,2x+y=03,解得:x=0.1,y=0.1,在含等物质的量的碳酸钠、碳酸氢钠的溶液中离子浓度大小关系:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(2)含等物质的量的碳酸钠、碳酸氢钠的溶液中电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-),
故答案为:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-);
(3))含等物质的量的碳酸钠、碳酸氢钠的溶液中物料守恒:2c(Na+)=3c(HCO3-)+3 c(CO32-)+3c(H2CO3),
故答案为:2c(Na+)=3c(HCO3-)+3 c(CO32-)+3c(H2CO3);
(4)含等物质的量的碳酸钠、碳酸氢钠的溶液中质子守恒:3c(H2CO3)+c(HCO3-)+2 c(H+)=2 c(OH-)+c(CO32-),
故答案为:3c(H2CO3)+c(HCO3-)+2 c(H+)=2 c(OH-)+c(CO32-).
点评 本题考查离子浓度大小的比较,确定溶液中的溶质及物质的量的关系是解答本题的关键,然后利用水解来解答即可,注意碳酸根离子水解程度大,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸锶难溶于水 | |
| B. | 铍是一种轻金属,它的氧化物的水化物可能具有两性 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹单质是一种有色固体,砹化氢很不稳定用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )| A. | A点时pH=1 | |
| B. | 恰好完全沉淀时Ba(OH)2溶液的体积为2L | |
| C. | B点时,溶液中的离子浓度关系为c(Na+)>c(SO42-)>c(H+)=c(OH-) | |
| D. | C点时pH=14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤⑧ | B. | ⑤⑥⑦⑧ | C. | 均不可 | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白醋中滴入石蕊试液呈红色 | |
| B. | 白醋加入豆浆中有沉淀产生 | |
| C. | 经检验白醋中c(H+)约为0.01 mol•L-1 | |
| D. | 蛋壳浸泡在白醋中有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
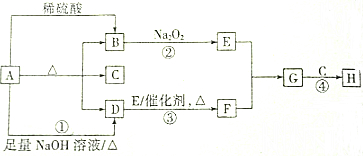
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
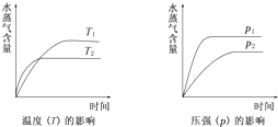
| A. | CH3CH2OH?CH2=CH2(g)+H2O(g);△H>0 | |
| B. | CO2(g)+H2(g)?CO(g)+H2O(g);△H>0 | |
| C. | CO2(g)+2NH3( g)?CO(NH2)2(s)+H2O(g);△H<0 | |
| D. | 2C6H5CH2CH3(g)+O2(g)?2C6H-5CH=CH2(g)+2H2O(g);△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com