
【题目】150℃时,将1L混合烃与9L氧气混合没在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是
A.甲烷与乙烷的体积比是1∶4B.丙炔与乙炔的体积比是1∶4
C.乙烯与丁烷的体积比是1∶4D.乙烯与丁烯的体积比是1∶4
【答案】D
【解析】
烃在氧气中充分燃烧的方程式为:CxHy+(x+![]() )O2→xCO2+
)O2→xCO2+![]() H2O,由该方程式分析可知,温度在150℃时,当y=4时,该反应为等体积反应;当y<4时,反应为气体体积减小的反应;当y>4时,反应为气体体积增大的反应,在A、B、C、D四个选项中,甲烷、丙炔、乙烯分子中H原子均4,所以关键是分析乙烷、乙炔、丁烷、丁烯的反应情况,反应后容器内压强增大8%,即气体体积增大:(1+9)8%L=0.8L;
H2O,由该方程式分析可知,温度在150℃时,当y=4时,该反应为等体积反应;当y<4时,反应为气体体积减小的反应;当y>4时,反应为气体体积增大的反应,在A、B、C、D四个选项中,甲烷、丙炔、乙烯分子中H原子均4,所以关键是分析乙烷、乙炔、丁烷、丁烯的反应情况,反应后容器内压强增大8%,即气体体积增大:(1+9)8%L=0.8L;
A.甲烷与乙烷体积比是1:4,乙烷的体积为0.8L,则
2C2H6+7O2→4CO2+6H2O气体体积增大△V
2 7 4 6 1
0.8 0.4L,
气体体积增大了0.4L,不符合题意,故A错误;
B.乙炔分子中含有2个H,属于反应后气体体积减小的反应,故B错误;
C.2C4H10+13O2→8CO2+10H2O气体体积增大△V
2 13 8 10 3
0.8L 1.2L,
气体体积增大了1.2L,不符合题意,故C错误;
D.C4H8+6O2→4CO2+4H2O气体体积增大△V
1 6 4 4 1
0.8L 0.8L
反应后气体体积增大了0.8L,符合题意,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】A、B两元素可形成AB型离子化合物,且阴、阳离子具有相同的电子数.A、B的单质均能与水发生剧烈反应,反应中A单质做还原剂,B单质做氧化剂,则下列表述正确的是![]()
A.B元素原子的电子排布式为1s22s22p63s23p5
B.化合物AB的电子式为![]()
C.化合物AB的电子式为![]()
D.A与水反应的离子方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生可逆反应:2X(g)![]() Y(g)+Z(s),下列选项能说明该反应达到平衡状态的是( )
Y(g)+Z(s),下列选项能说明该反应达到平衡状态的是( )
A.X的分解速率与Y的分解速率相等
B.X、Y、Z的物质的量之比为2:1:1
C.混合气体的密度不再变化
D.单位时间内生成1molY的同时分解2molx
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.61×10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是__(填化学式)。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为__。
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是_。
A.c(H+) B.c(H+)c(CH3COO-) C.c(H+)c(OH-) D.![]()
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1__V2(填“>”、“<”或“=”)。
(5)下列四种离子结合H+能力最强的是__。
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(6)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是___
A.Va>10Vb B.Va<10Vb C.Vb<10Va D.Vb>10Va
(7)25℃时,0.1mol/L CH3COOH溶液的pH约为3,向其中加入CH3COONa晶体,待晶体溶解后发现溶液的pH增大。可能的原因有:①__;②__;为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L CH3COOH溶液中加入少量下列物质中的__(选填字母编号),然后测定溶液的pH。
a.CH3COOK固体 b.CH3COONH4固体 c.NH3 d.NaHCO3固体
(8)已知100℃时,水的离子积常数Kw=1.0×10-12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈__性;
(9)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3H2O溶液中,NH4+浓度由大到小的顺序是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )
A. 它的系统名称是2,4-二甲基-4-戊烯
B. 它的分子中至少有5个碳原子在同一平面上
C. 它与甲基环己烷(![]() )互为同分异构体
)互为同分异构体
D. 该有机物与氢气完全加成后的产物的一氯取代产物共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图如下:


请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为________________;
(2)支管B的作用是__________;加入氨水的作用是________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙_____________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)

①检查该装置气密性的方法是:____________________;
②使用分析天平准确称取0.5000g样品,置于试管中加热使其完全分解,收集到 33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________(保留4位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青花瓷,俗称青花,是中国瓷器的主流品种之一。某同学利用如下方法来粗略测定青花瓷瓶的容积,把![]() NaCl晶体放入到500mL烧杯中,加入200mL蒸馏水,待NaCl完全溶解后,将溶液
NaCl晶体放入到500mL烧杯中,加入200mL蒸馏水,待NaCl完全溶解后,将溶液![]() 包括洗涤液
包括洗涤液![]() 全部转移到该瓶中,用蒸馏水稀释至完全充满容器。从中取出100mL溶液,该溶液恰好能与10mL
全部转移到该瓶中,用蒸馏水稀释至完全充满容器。从中取出100mL溶液,该溶液恰好能与10mL![]() 的
的![]() 溶液完全反应。则下列说法正确的是( )
溶液完全反应。则下列说法正确的是( )
A.该青花瓷瓶的容积约为![]()
B.常温下,该青花瓷瓶几乎能容纳56kg![]()
C.常温常压下,该青花瓷瓶能容纳70g![]()
D.标准状况下,充满HCl气体,加满水后所得溶液物质的量浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R为元素周期表中的电负性最强的元素。则下列判断正确的是( )
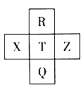
A.非金属性:Z<T<X
B.R与Q的电子数相差24
C.气态氢化物的沸点:R<T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com