
| A. | 碳酸的电离方程式:H2CO3?H++CO32- | |
| B. | 少量二氧化硫通入氢氧化钠溶液中的化学方程式:SO2+NaOH═NaHSO3 | |
| C. | 碳酸氢钠溶液显碱性:HCO3-+H2O═H3O++CO32- | |
| D. | 向小苏打溶液中加入过量的石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
分析 A.碳酸电离分步进行,以第一步为主;
B.反应生成亚硫酸钠和水;
C.水解生成碳酸和氢氧根离子;
D.小苏打完全反应,生成碳酸钙、水、NaOH.
解答 解:A.碳酸的电离方程式为H2CO3?H++HCO3-,故A错误;
B.少量二氧化硫通入氢氧化钠溶液中的化学方程式为SO2+2NaOH═Na2SO3+H2O,故B错误;
C.碳酸氢钠溶液显碱性,水解的离子反应为HCO3-+H2O?H2CO3+OH-,故C错误;
D.向小苏打溶液中加入过量的石灰水的离子反应为Ca2++OH-+HCO3-═CaCO3↓+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、水解反应的离子反应考查,题目难度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:填空题

 Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).
Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加酶洗衣粉洗衣服时,温度越高效果越好 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 乙二醇可用来生产聚酯纤维和作汽车发动机的抗冻剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醇的化学性质主要由羧基官能团所决定,如1-丁醇在银催化的条件下能与氧气反应生成正丁醛.相应醇和醛的有关物理性质如表:
醇的化学性质主要由羧基官能团所决定,如1-丁醇在银催化的条件下能与氧气反应生成正丁醛.相应醇和醛的有关物理性质如表:| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1-丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中,共价键的键能越大,熔沸点越高 | |
| B. | 分子晶体中,分子间作用力越大,该分子越稳定 | |
| C. | 金属阳离子只能与阴离子构成晶体 | |
| D. | 正四面体构型的分子中,键角一定为109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl- 不可能存在 | B. | 100 mL溶液中含0.01 mol CO32- | ||
| C. | K+一定存在 | D. | Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
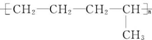 的单体是CH2═CH-CH3、CH2═CH2;(写结构简式)
的单体是CH2═CH-CH3、CH2═CH2;(写结构简式)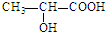 )中的官能团名称是:羟基、羧基;两分子乳酸在浓硫酸加热的条件下,可生成一种环状酯,写出此酯的结构简式:
)中的官能团名称是:羟基、羧基;两分子乳酸在浓硫酸加热的条件下,可生成一种环状酯,写出此酯的结构简式: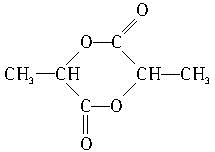 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
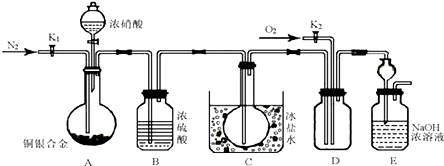
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com