
| A.ⅠA族元素成键时不可能有杂化轨道 |
| B.杂化轨道既可能形成σ键,也可能形成π键 |
| C.孤对电子有可能参加杂化 |
| D.s轨道和p轨道杂化不可能有sp4出现 |
科目:高中化学 来源:不详 题型:单选题
| A.只含有共价键的物质不一定是共价化合物 |
| B.由电子定向移动而导电的物质一定是金属晶体 |
| C.有键能很大的共价键存在的物质熔沸点一定很高 |
| D.原子晶体中只存在非极性共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可能在某种物质中含有离子键 |
| B.四种物质都是共价化合物 |
| C.四种物质都不可能具有强氧化性 |
| D.有一种物质是乙烷的同系物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强 |
| B.在氯化钠中,氯离子和钠离子靠静电作用结合 |
| C.任何离子键在形成的过程中必定有电子的得与失 |
| D.金属钠与氯气反应生成氯化钠后,体系能量降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分子中所有原子在同一平面内 |
| B.分子中不含氢原子 |
| C.在ABn分子中,A元素为最高正价 |
| D.在ABn型分子中,A原子最外层电子都已成键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K2O、MgO、CaO | B.MgO、K2O、CaO |
| C.MgO、CaO、K2O | D.CaO、MgO、K2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
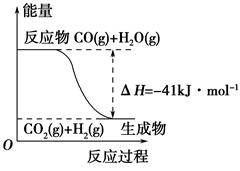

| A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1 |
| B.该反应为吸热反应 |
| C.该反应为放热反应 |
| D.当H2O为液态时,其反应热值小于41 kJ·mol-1 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | | | |
| X | | | |
| W | Y | | R |
| | | Z | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com