
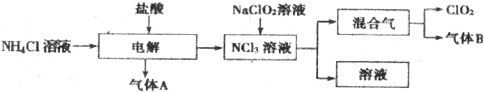
分析 (1)Cl最外层7个电子,只有1个单电子,O最外层6个电子,含2个单电子;产物中杂质气体B能使石蕊试液显蓝色,为氨气,可选酸来除杂;
(2)高效“绿色”消毒剂二氧化氯,可推广使用,代替氯气;
(3)氯酸钠氧化浓盐酸生成氯化钠、氯气、二氧化氯、水;
(4)氯气与固体亚氯酸钠(NaClO2)反应,生成氯化钠和二氧化氯;
(5)用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,反应生成硫酸钠、二氧化碳、二氧化氯、水,以此来解答.
解答 解:(1)Cl最外层7个电子,只有1个单电子,O最外层6个电子,含2个单电子,则O原子不能满足8电子稳定结构,产物中杂质气体B能使石蕊试液显蓝色,为氨气,可选酸来除杂,只有C中浓硫酸符合,
故答案为:不是;C;
(2)A.二氧化氯可广泛用于工业和饮用水处理,代替氯气,为“绿色”消毒剂,故A正确;
B.应用在食品工业中能有效地延长食品贮藏期,能杀菌消毒,故B正确;
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围,便于运输和应用,故C正确;
D.二氧化氯是一种极易爆炸的强氧化性气体,在工作区和成品储藏室内,要有通风装置和监测及警报装,故D正确;
故答案为:A、B、C、D;
(3)氯酸钠氧化浓盐酸生成氯化钠、氯气、二氧化氯、水,该反应为2NaClO3+4HCl(浓)═2NaCl+Cl2↑+2ClO2↑+2H2O,
故答案为:2NaClO3+4HCl(浓)═2NaCl+Cl2↑+2ClO2↑+2H2O;
(4)氯气与固体亚氯酸钠(NaClO2)反应,生成氯化钠和二氧化氯,该反应为2NaClO2+Cl2═2NaCl+2ClO2,该法相比欧洲方法的优点为安全性好,没有产生毒副产品,
故答案为:2NaClO2+Cl2═2NaCl+2ClO2;安全性好,没有产生毒副产品;
(5)用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,反应生成硫酸钠、二氧化碳、二氧化氯、水,该反应为H2C2O4+2NaClO3+H2SO4═Na2SO4+2CO2↑+2ClO2↑+2H2O,
此法提高了生产及储存、运输的安全性,原因是反应过程中生成的二氧化碳起到稀释作用,
故答案为:H2C2O4+2NaClO3+H2SO4═Na2SO4+2CO2↑+2ClO2↑+2H2O;反应过程中生成的二氧化碳起到稀释作用.
点评 本题考查二氧化氯的性质及应用,注意把握所给信息来分析解答,侧重学生解决新问题能力的考查,将知识活学活用为解答的关键,题目难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:解答题

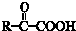 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$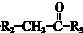
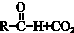 $→_{△}^{NaOH(ap)}$R1-
$→_{△}^{NaOH(ap)}$R1-
 .
.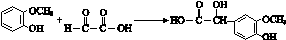 ;其反应类型是加成反应.
;其反应类型是加成反应.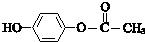 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、SO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、K+ | B. | Na+、Cu2+、Br-、Ba2+ | ||
| C. | K+、MnO${\;}_{4}^{-}$、NO${\;}_{3}^{-}$、Na+ | D. | K+、Ca2+、SO${\;}_{3}^{2-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
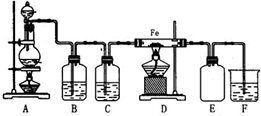 实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题:
实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是部分短周期元素的单质及其化合物的转化关系图
如图是部分短周期元素的单质及其化合物的转化关系图| 溶液酸碱性 | 离子浓度大小顺序 | |
| 1 | 酸性 | |
| 2 | 中性 | |
| 3 | 碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | |
| 四氯化锡 | 2.2 | -33 | 114 |
| 金属锡 | 5.77 | 231 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com