
【题目】α-氰基丙烯酸异丁酯可用作医用胶,其结构简式如下。下列关于α-氰基丙烯酸异丁酯的说法错误的是

A.其分子式为 C8H11NO2
B.分子中的碳原子有3种杂化方式
C.分子中可能共平面的碳原子最多为6个
D.其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)
(1)反应(Ⅰ)中氧化剂是_____________________________。
(2)火箭残骸中常出现红棕色气体,原因为:N2O4(g) ![]() 2NO2(g)(Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
2NO2(g)(Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是____________。

若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数______(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)= ________mol·L-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )

A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是( )

A.该反应的还原剂是Cl-
B.消耗1 mol还原剂,转移3 mol电子
C.氧化剂与还原剂的物质的量之比为2∶3
D.反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表),经X射线衍射测得R的局部结构如图所示,下列说法正确的是( )

A.R中两种阳离子的中心原子的杂化轨道类型相同,但化学键类型不同
B.1molR中σ键总数为15个
C.N5-中参与形成的大π键电子数为6个
D.已知图中虚线代表氢键,其中一个表示为(NH4)N﹣H···Cl,则化合物R中共有4个不同类型氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ. ![]()
![]()
Ⅱ. ![]()
![]()
Ⅲ. ![]()
![]()
回答下列问题:
(1)![]() _________
_________![]() 。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为__________mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
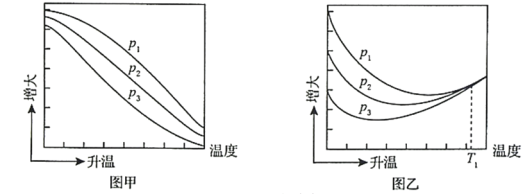
已知:CO2的平衡转化率=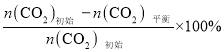
CH3OH的平衡产率=![]()
其中纵坐标表示CO2平衡转化率的是图___________(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________;图乙中T1温度时,三条曲线几乎交于一点的原因是___________。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________(填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,
装置如图所示,其中Y为CO2。下列说法合理的是( )
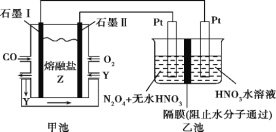
A.石墨Ⅰ是原电池的正极,发生氧化反应
B.甲池中的CO32-向石墨Ⅱ极移动
C.乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+
D.若甲池消耗标准状况下的氧气2.24L,则乙池中一定能产生氢气0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,通电5min后,C中Cu电极的质量增加1.08g。假设电解过程中溶液的体积不变。

(1)电源中Y是______极。A池中阳极的电极反应式为______,C池中阴极的电极反应式为______。
(2)通电5min后,如果B槽中共收集到112mL气体(标准状况),且溶液体积1000mL,计算通电前溶液中Cu2+的物质的量浓度______。
(3)如果A池溶液是1000mL食盐水(假设电解液足量),则通电5min后,常温下溶液的pH为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学各设计了一个实验,结果各自都认为自己的试样中含有SO42-离子。
甲的实验为:
![]()
(1)乙认为甲的实验不严谨,因为试样A中若含有________离子(仅填一种)也会有此现象。
乙的实验为:
![]()
(2)丙认为乙的实验也不严谨,因为试样B中若含有________离子(仅填一种)也会有此现象。
丙的实验为:
![]()
若丙方案合理,回答:
(3)若丙实验合理,则其中试剂Ⅰ是___________,现象Ⅰ是__________;试剂Ⅱ是___________,现象Ⅱ是__________。(若你认为丙方案不合理,以上四空可以不填)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com