
| m |
| M |
| m |
| n |
| N |
| NA |
| 0.9mol |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 2g |
| 4g/mol |
| 1.4g |
| 28g/mol |
| 1.6g |
| 32g/mol |
| 16 |
| 4 |
| 9 |
| 4 |
| 36g |
| 2mol |
| cb |
| a |
| ||
| NAmol-1 |
| bc |
| aNA |
| bc |
| aNA |
| 22.4bc |
| aNA |
| 22.4bc |
| aNA |


科目:高中化学 来源: 题型:
| A、镁合金为电源负极,发生氧化反应 |
| B、电解质溶液中的H+向正极移动 |
| C、正极反应为:H2O2+2e-=2OH- |
| D、放电时正极周围溶液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,92g的NO2和N2O4 混合气体含有的原子数为6NA |
| B、标准状况下,22.4L C2H5OH中含有的氢原子数为6NA |
| C、常温常压下,3.0g乙烷中含有的碳氢键数为0.7NA |
| D、标准状况下,由Na2O2制得11.2L O2,反应转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向甲、乙两个容积均为1L的恒容容器中,分别通入2mol A、2mol B和1mol A、1mol B.相同条件下,发生反应:A(g)+B(g)?xC(g)△H<0,测得两容器中c(A) 随时间t的变化如图.下列说法正确的是
向甲、乙两个容积均为1L的恒容容器中,分别通入2mol A、2mol B和1mol A、1mol B.相同条件下,发生反应:A(g)+B(g)?xC(g)△H<0,测得两容器中c(A) 随时间t的变化如图.下列说法正确的是| A、x等于2 |
| B、向平衡后的乙容器中充入氦气可使c(A)增大 |
| C、将甲容器单独升温可使甲容器内各物质的体积分数与乙容器内的相同 |
| D、若向甲中再充2mol A、2mol B,则平衡时甲中c(A)>1.56mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol H2O的质量为18g/mol |
| B、标准状况下,1mol任何物质体积均为22.4L |
| C、3.01×1023个SO2分子的质量为32g |
| D、CH4的摩尔质量为16g |
查看答案和解析>>
科目:高中化学 来源: 题型:
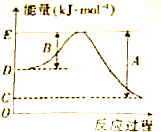 下表列出了断裂某些化学键的热量值
下表列出了断裂某些化学键的热量值| 化学键 | H-H | Cl-Cl | I-I | O═O | C-Cl | C-H | O-H | H-Cl | H-I |
| 断裂1mol化学键所吸收的能量(kJ) | 436 | 247 | 151 | x | 330 | 413 | 463 | 431 | 299 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com