
【题目】某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示。该小组欲配制450 mL 0.2 mol·L-1的稀H2SO4溶液:

(1)所需试剂瓶内硫酸溶液的体积为________mL。
(2)所用量筒和容量瓶的规格为________和________。
(3)浓硫酸稀释时的操作是________________________。
(4)下列为该小组的操作,可能导致配制溶液浓度偏高的是________。
A.移液前未冷却至室温
B.定容时加水多了,用滴管吸出
C.定容时俯视刻度线
【答案】5.4 10 mL量筒 500 mL容量瓶 向烧杯中加入一定量的水,再将浓硫酸沿烧杯内壁慢慢倒入,并用玻璃棒不断搅拌 AC
【解析】
(1)先计算浓硫酸的物质的量浓度为c=1000ρω/M,然后根据溶液稀释定律c浓·V浓=c稀·V稀来计算;
(2)根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,据此选择;
(3)根据浓硫酸的密度大于水,溶于水放热分析;
(4)根据c=n÷V并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析。
(1)浓硫酸的物质的量浓度为c=1000ρω/M=1000×1.84×98%/98 mol·L-1=18.4mol/L,由于无450mL容量瓶,故选用500mL容量瓶,配制出500mL的溶液,设需要的浓硫酸的体积为VmL,根据溶液稀释定律可知18.4mol/L×VmL=0.2mol/L×500mL,解得V=5.4;
(2)根据“大而近”的原则,根据需要量取的浓硫酸的体积为5.4mL来选择合适的量筒,故应选择10mL的量筒;容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,由于无450mL容量瓶,故选用500mL容量瓶;
(3)由于浓硫酸溶于水放热,且密度大于水,则浓硫酸稀释时的操作是向烧杯中加入一定量的水,再将浓硫酸沿烧杯内壁慢慢倒入,并用玻璃棒不断搅拌;
(4)A、移液前未冷却至室温,冷却后溶液体积减少,浓度偏高;
B、定容时加水多了,用滴管吸出,会导致溶质损失,则浓度偏小;
忘记将洗涤液转入容量瓶,会导致溶质损失,则浓度偏小,故B正确;
C、定容时俯视刻度线,溶液体积减少,浓度偏高;
答案选AC。


科目:高中化学 来源: 题型:
【题目】CO2的的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→ +H2O。下列有关三聚氰胺的说法正确的是
+H2O。下列有关三聚氰胺的说法正确的是
A. C、N、O原子采用相同的杂化方式 B. 分子中所有原子一定共平面
C. 分子式为C3H3N3O3 D. 生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金相对于金属单质具有许多优良的物理、化学与机械性能。下列有关合金的叙述错误的是
A.目前我国使用量最大的合金是铝合金B.我国最早使用的合金是青铜
C.合金的熔点一般比其成分金属的熔点低D.合金中也可能含有非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

(1)R溶液中,离子浓度由大到小的顺序是___________________________________
(2)写出m点反应的离子方程式:__________________________________________。
(3)若在R溶液中改加20mL 1.2mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
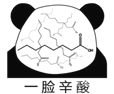
A. 7种 B. 11种 C. 14种 D. 17种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:
①Na2CO3 ②BaCl2 ③NaOH ④HCl。加入试剂合理的操作顺序是
A.①②③④B.③①②④C.③②①④D.④②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使充分反应,反应放出的能量总小于上述数值,为什么___________?
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10分钟后,生成10 mol 氨气,则用氮气表示的化学反应速率是________ mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.氮气的转化率达到最大值
d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大程度
(5)根据题目所给条件,判断影响该反应速率的因素有________、________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化。下列说法正确的是( )
A. FexO溶于足量盐酸后只生成了FeCl3和H2O
B. 标准状况下112 mL Cl2的物质的量是5 mol
C. x=0.8
D. 通入Cl2后,发生反应的离子方程式:Fe2++Cl2![]() Fe3++2Cl﹣
Fe3++2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是( )

A. B为第二周期的元素
B. C为VA族元素
C. 三种元素都为非金属元素
D. B是三者中化学性质最活泼的非金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com