
【题目】下图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
硫酸
分子式:H2SO4
相对分子质量:98
密度:1.84g/mL
H2SO4的质量分数:98%
(1)该浓硫酸中H2SO4的物质的量浓度为_________。
(2)某学生欲用上述浓硫酸和蒸馏水配制100mL物质的量浓度为0.8 mol·L-1的稀硫酸,该学生需要量取_________mL上述浓硫酸进行配制。
(3)为配制(2)中的稀硫酸,除了量筒、烧杯、胶头滴管外,还缺少的玻璃仪器是_________。
(4)在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是_________(填序号)。
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.容量瓶未干燥即用来配制溶液
e.往容量瓶转移时,有少量液体溅出;
f.未洗涤稀释浓硫酸的烧杯;
【答案】 18.4 mol·L-1 4.3 玻璃棒、100mL容量瓶 ac
【解析】试题分析:本题考查物质的量浓度与溶质质量分数的换算,配制物质的量浓度的溶液和误差分析。
(1)c=![]() =
=![]() =18.4mol/L。
=18.4mol/L。
(2)c(浓硫酸)V(浓硫酸)=c(稀硫酸)V(稀硫酸),V(浓硫酸)=![]() =4.3mL。
=4.3mL。
(3)由浓硫酸配制稀硫酸需要的仪器有:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,还需要玻璃棒、100mL容量瓶。
(4)根据公式cB=![]() 分析。a项,定容时俯视观察,溶液体积偏小,所配溶液浓度偏高;b项,定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水,溶液体积偏大,所配溶液浓度偏低;c项,浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移,浓硫酸溶于水放热,冷却后溶液体积偏小,所配溶液浓度偏高;d项,容量瓶未干燥即用来配制溶液,对实验结果无影响;e项,往容量瓶转移时,有少量液体溅出,溶质物质的量偏小,所配溶液浓度偏低;f项,未洗涤稀释浓硫酸的烧杯,溶质物质的量偏小,所配溶液浓度偏低;答案选ac。
分析。a项,定容时俯视观察,溶液体积偏小,所配溶液浓度偏高;b项,定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水,溶液体积偏大,所配溶液浓度偏低;c项,浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移,浓硫酸溶于水放热,冷却后溶液体积偏小,所配溶液浓度偏高;d项,容量瓶未干燥即用来配制溶液,对实验结果无影响;e项,往容量瓶转移时,有少量液体溅出,溶质物质的量偏小,所配溶液浓度偏低;f项,未洗涤稀释浓硫酸的烧杯,溶质物质的量偏小,所配溶液浓度偏低;答案选ac。


科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A.单糖是不能发生水解的最简单的糖类
B.分子式符合Cn(H2O)m的物质,都是糖类物质
C.淀粉和纤维素都是天然有机高分子化合物
D.淀粉和纤维素都是由碳氢氧三种元素组成,两化合物中三元素的质量比相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 22.4LN2含阿伏加德罗常数个氮分子
B. 在标准状况下,22.4L水的质量约为18g
C. 标准状况下,相同体积的任何气体单质所含的原子数相同
D. 22g二氧化碳与标准状况下11.2LHCl含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的流程如下:

(1)溶液X是 。
(2)检验滤液中是否存在K+的操作是 。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CaO+H2O=Ca(OH)2可放出大量热,可利用该反应设计原电池,把化学能转化为电能
B.任何化学反应中的能量变化都表现为热量变化
C.化学反应一定有化学键断裂,有化学键断裂一定发生化学反应
D.灼热的铂丝与NH3、O2混合气接触,铂丝继续保持红热,说明氨的氧化反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 1s电子云界面图是一个球面,电子云中的每个小黑点代表一个电子
B. NaH中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠形成的
C. 对于组成结构相似的分子,一定是相对分子质量越大,熔、沸点越高
D. 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A. 氧气是氧化产物 B. O2F2既是氧化剂又是还原剂
C. 若生成4.48 L HF,则转移0.8 mol电子 D. 还原剂与氧化剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸与金属反应,浓度不同生成的还原产物也可能不同。某兴趣小组进行了如下实验探究。

[查阅资料]
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示
b.NO2沸点:21 ℃;NO沸点:-151 ℃
c.2NO2+2OH-===NO![]() +NO
+NO![]() +H2O,NO+NO2+2OH-===2NO
+H2O,NO+NO2+2OH-===2NO![]() +H2O
+H2O
(1)请写出Mg放入10 mol·L-1硝酸中反应的化学方程式:______________________;
[实验探究] 该小组拟选用如图A B C D所示装置探究镁与4 mol·L-1硝酸反应的产物。连接装置A→B→C→D→C,检查气密性,按图示加入试剂,D中通入的O2微过量。
(2)a仪器的名称是_____________。
(3)前一个C装置的作用是_______,证明气体产物中有NO生成的实验现象是______。
(4)从后一个C装置中逸出的气体是________。
(5)某同学测想A溶液中可能还有一种还原产物NH4NO3,请设计实验验证他的猜想_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废料料中含有Cr(OH)3、Al2O3、CuO、NiO等物质,工业上通过下列流程回收其中有用的金属和制取Na2Cr2O7。
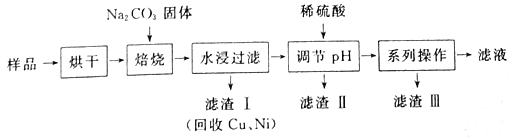
已知:
①“水浸过滤”后的溶液中存在Na2CrO4、NaAlO2等物质
②除去滤渣II后,溶液中存在反应2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
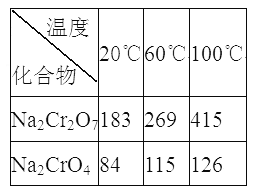
③Na2Cr2O7、Na2CrO4在不同温度下的溶解度(g/100 g H2O)如下表:
(1) “焙烧”过程中生成NaAlO2化学方程式为_____________________。
(2)生成滤渣II时,需加入适量稀硫酸调节溶液的pH除去A1O2-。若稀硫酸过量,则过量后引起反应的离子方程式为______________________。
(3) “系列操作”为:继续加入稀硫酸、_____、冷却结晶、过滤。继续加入稀硫酸的目的是_____________,滤渣III的主要成分是_________(填化学式)。
(4)工业上还可以在“水浸过滤’’后的溶液中加人适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为______________。
(5)流程图最后的“滤液”中仍然有残留的Na2Cr2O7。Cr为重金属元素,若含量过高就排入河流中,会对河水造成重金属污染。为测定“滤液”中的c(Na2Cr2O7),某实验小组取“滤液”20mL,水稀释至250 mL,再取稀释后的溶液25 mL于锥形瓶中,用c mol L-1的FeSO4溶液进行氧化还原滴定,到终点时消耗FeSO4溶液体积为V mL,则“滤液”中的c(Na2Cr2O7)=______mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com