

| 6000g |
| 12g/mol |
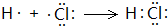 ,故答案为:
,故答案为: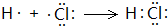 ;
;| 6000g |
| 12g/mol |
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
查看答案和解析>>
科目:高中化学 来源: 题型:

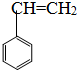 ;②CH3-CH=CH-CH3; ③CH2=CH-CH=CH2;④CH≡C-CH3;⑤
;②CH3-CH=CH-CH3; ③CH2=CH-CH=CH2;④CH≡C-CH3;⑤
| A、①② | B、④⑤ | C、③⑤ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | Y |
| Z |
| 编号 | 推测性质 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
| ① | ||
| ② | H2ZO3+Br2+H2O=H2ZO4+2HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com