
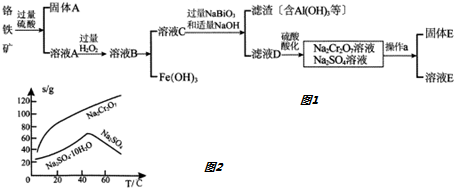

分析 铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质),加入过量稀硫酸,固体A为SiO2,溶液B中含有Cr3+、Al3+、Fe2+,在B中加入过氧化氢,可生成Fe3+,调节溶液pH可除去Fe3+,生成氢氧化铁,加入NaBiO3和NaOH,发生氧化还原反应,得到氢氧化铝沉淀,溶液D含有Na2CrO4,酸化可得Na2Cr2O7,溶液经蒸发浓缩、冷却结晶可得Na2Cr2O7•2H2O,
(1)Fe0•Cr2O3和硫酸反应,生成易溶于水易电离的硫酸亚铁和硫酸铬,据此书写离子反应方程式;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;
(3)盐酸中的氯是-1价具有还原性,会CrO42-被氧化成氯气;
(4)由图2可知Na2Cr2O7的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠;
(5)①Cr(OH)3的化学性质与Al(OH)3相似,如果氢氧化钠过量Cr(OH)3会溶解;
②可以代替上述流程中Na2S2O3溶液,需要具有还原性,能还原重铬酸根离子;
③氧化还原反应中还原剂失去的电子,每失去1个电子化合价升高1价,据此计算S2O32-的氧化产物;
④根据Ksp[Cr(OH)3]=c(Cr3+)•(OH-)3,来计算铬离子的浓度.
解答 解:(1)Fe0•Cr2O3和硫酸反应,生成易溶于水易电离的硫酸亚铁和硫酸铬,反应的离子方程式为:Fe0•Cr2O3+8H+=Fe2++2Cr3++4H2O,
故答案为:Fe0•Cr2O3+8H+=Fe2++2Cr3++4H2O;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,便于调节溶液PH沉淀铁离子分离,以便除去,
故答案为:将Fe2+全部氧化为Fe3+,以便除去;
(3)盐酸中的氯是-1价具有还原性,会CrO42-被氧化成氯气,导致原料损失,
故答案为:盐酸中的Cl-会被氧化,产生Cl2,导致原料损失;
(4)由图2可知Na2Cr2O7的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠,
故答案为:趁热过滤;
(5)①Cr(OH)3的化学性质与Al(OH)3相似,如果氢氧化钠过量Cr(OH)3会溶解,反应为:Cr(OH)3+OH-=CrO2-+2H2O,
故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
②A.Na2SO3溶液中亚硫酸根离子具有还原性,可以还原Cr2O72-,故A符合;
B.浓H2SO4具有强氧化性,不能表现还原性,不能还原Cr2O72-,故B不符合;
C.酸性KMnO4溶液是强氧化剂不能还原Cr2O72-,故C不符合;
D.FeSO4溶液中亚铁离子具有还原性,可以还原Cr2O72-离子,但又引入新的杂质离子铁离子,故D不符合;
故答案为:A;
③Cr2O72-与Na2S203反应,Cr2O72-为氧化剂,Na2S203为还原剂,每消耗0.1mol Na2S203转移0.8mol e-、即1molNa2S203转移8mole-,平均1个硫失去4个电子,Na2S203中硫为+2价,升高4价,则S2O32-的氧化产物为SO42-,
故答案为:SO42-;
④pH=6时,C(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-6}}$=10-8mol/L,所以c(Cr3+)•(10-8)3=6.3×10-31,解之得c(Cr3+)=6.3×10-7,
故答案为:6.3×10-7.
点评 本题考查重铬酸钠的制备实验及混合物的分离和提纯,为高频考点,把握流程图中每一步发生的反应及操作方法是解本题关键,注意结合题给信息解答,侧重分析与实验能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
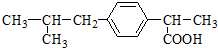
| A. | 该物质属于不饱和烃 | B. | 该物质的分子式为C13H20O2 | ||
| C. | 该物质属于羧酸类有机物 | D. | 该物质属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为34 | |
| B. | 最高价氧化物的水化物的分子式为:H2SeO4 | |
| C. | Br的非金属性比Se强 | |
| D. | 气态氢化物的还原性比硫化氢气体弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 制备碳酸氢钠,然后用碳酸氢钠制备碳酸钠.
制备碳酸氢钠,然后用碳酸氢钠制备碳酸钠.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
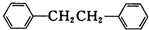 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为: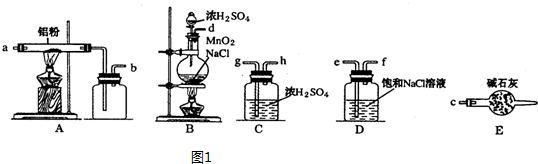
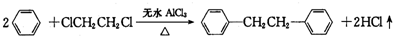
| 名称 | 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2一二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
| 联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )| A. | 芥子醇分子中有两种含氧官能团 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面上 | |
| C. | 芥子醇与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 芥子醇能发生的反应类型有氧化、还原、取代、加成、聚合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
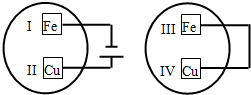 把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )
把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )| A. | II和III附近 | B. | II和IV附近 | C. | I和III附近 | D. | I和IV附近 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
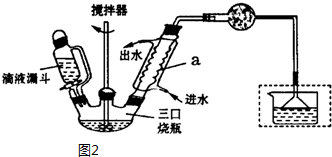
 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com