
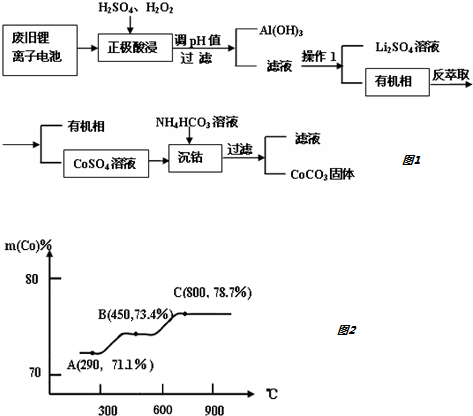
分析 正极材料酸浸,并且加入稀硫酸、双氧水,涉及的氧化还原反应有2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O、2Al+3H2SO4=Al2(SO4)3+3H2↑、2H2O$\frac{\underline{\;80°C\;}}{\;}$O2↑+2H2O;调节溶液的pH得到Al(OH)3沉淀,过滤得到滤液和Al(OH)3,通过操作1得到Li2SO4和有机相,操作1为萃取分液,然后反萃取得到有机相和CoSO4,向溶液中加入碳酸氢铵溶液,发生反应为CO32-+Co2+=CoCO3↓,
(1)在酸性条件下,LiCoO2和双氧水发生氧化还原反应,铝和硫酸发生氧化还原反应;2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O中氧化产物是氧气,根据LiCoO2和氧气之间的关系式计算;
(2)根据溶度积常数计算氢氧根离子浓度,结合离子积常数计算得到溶液中氢离子浓度,计算得到溶液pH;
(3)操作Ⅰ是加入有机相萃取硫酸钴,该操作是萃取、分液;
(4)浓度积大于溶度积时产生沉淀;
(5)钴元素与铁元素都属于第 VIII族,它们的化合物有相似的性质,Co(OH)2在空气中加热时,根据FeFe的氧化物,则Co的氧化物可能为Co2O3、CoO、Co3O4,Co2O3中Co的含量=$\frac{59×2}{59×2+16×3}$×100%=71.1%、CoO中Co的含量=$\frac{59}{75}$×100%=78.7%、Co3O4中Co的含量=$\frac{59×3}{59×3+16×4}$×100%=73.4%,
根据Co元素含量确定固体成分.
解答 解:(1)根据工艺流程中酸浸的过程中发生氧化还原反应有2LiCoO2+3 H2SO4+H2O2=Li2SO4+2 CoSO4+O2↑+4H2O,
2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O中氧化产物是氧气,1molLiCoO2完全反应生成氧气0.5mol,其质量为16g,
故答案为:2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O;16g;
(2)离子浓度等于或小于1.0×10-6时,认为其完全沉淀;(OH-)3=$\frac{Ksp}{c(A{l}^{3+})}$=$\frac{1.13×1{0}^{-33}}{1{0}^{-6}}$,c(OH-)=10-9 mol•L-1,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-9 mol•L-1,pH=5,
故答案为:5;
(3)该操作是萃取、分液,操作1的名称是萃取分液,
故答案为:萃取分液;
(4)平衡移动原理,溶液中HCO3-?H++CO32- Co2+浓度与CO32- 浓度积即为浓度积大于CoCO3的Ksp 向生成沉淀的方向移动,
故答案为:HCO3-存在电离平衡:HCO3-?H++CO32-,当电离产生的CO32-浓度与溶液中Co2+浓度的积(即浓度积)大于CoCO3的Ksp时,对于溶解平衡:CoCO3(S)? Co2+(aq)+CO32-(aq)而言,平衡将向生成沉淀的方向移动;
(5)钴元素与铁元素都属于第 VIII族,它们的化合物有相似的性质,Co(OH)2在空气中加热时,根据FeFe的氧化物,则Co的氧化物可能为Co2O3、CoO、Co3O4,Co2O3中Co的含量=$\frac{59×2}{59×2+16×3}$×100%=71.1%、CoO中Co的含量=$\frac{59}{75}$×100%=78.7%、Co3O4中Co的含量=$\frac{59×3}{59×3+16×4}$×100%=73.4%,
所以A点成分为Co2O3,在550-600℃范围内,剩余固体的成分为Co3O4和CoO,
故答案为:Co2O3;CoO、Co3O4.
点评 本题考查物质分离和提纯,涉及工业流程、氧化还原反应、信息型方程式书写、Ksp计算、物质分离和提纯、化学平衡移动原理,综合性较强,把握基本反应原理及物质性质是解本题关键,侧重考查学生分析计算能力,难点是(5)题固体成分判断,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )| A. | N4与N2互称为同位素 | |
| B. | N4属于一种新型的化合物 | |
| C. | N4化学性质比N2稳定 | |
| D. | 1mol N4气体转化为N2时要放出882kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 反应物的性质是决定反应速率快慢的主要因素 | |
| C. | 相同体积、不同浓度的盐酸分别与大小、形状都相同的铁片反应的速率:1 mol•L-1时<0.1 mol•L-1时 | |
| D. | 在不同温度时,鲜牛奶变酸的速率:28℃时>5℃时 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=7的NH4Cl和NH3•H2O混合溶液中,含有OH-的数目为10-7NA | |
| B. | 一定条件下6.4gSO2与足量氧气反应,转移的电子数为0.2NA | |
| C. | 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na-的浓度为2mol•L-1 | |
| D. | 46gC2H4O中含有的C-H键数目一定为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H3PO4>H2SO4 | B. | 氢化物稳定性:HF>H2O>NH3 | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 氧化性:F2>O2>N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com