
(15分)
某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应.其中D为纯净干燥的氯气与纯净干燥氨气反应的装置.

请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是 。
(2)装置E的作用是 ,橡胶管k的作用是 。
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是 。
(4)装置F中试管内发生反应的化学方程式____ 。
(5)接入D装置的两根导管左边较长、右边较短,目的是______ .
(6)整套装置从左向右的连接顺序是(j)接( )( )接(f)(g)接( )( )接( )( )接(a).
(15分)
(1)检查装置的气密性(1分)
(2)除去氯气中的氯化氢(2分)使分液漏斗中的盐酸顺利流下(2分)
(3)在G连接导管直接通入盛有烧碱的烧杯中(2分)
(4)2NH4Cl+Ca(OH)2 △ CaCl2+2H2O+2NH3↑(3分)
(5)使密度大的氯气与密度小的氨气较快地均匀混合(2分)
(6)(j)接(d)(e)接(f)(g)接(b)(c)接(h)(i)接(a)(3分,全对才得分)
【解析】
试题分析:(1)连接好装置后,需进行装置气密性的检查;
(2)D为纯净干燥的氯气与纯净干燥氨气反应的装置,所以反应前应先除杂、干燥,因此装置E的作用是除去氯气中的氯化氢气体,橡胶管k与分液漏斗的上口相连,达到连通器的效果,方便浓盐酸顺利滴下;
(3)从G处逸出黄绿色气体氯气,氯气有毒,直接排放会污染空气,所以应在G处接一导气管通入氢氧化钠溶液中;
(4)F为实验室制取氨气的装置,所以F中发生的化学方程式为
2NH4Cl+Ca(OH)2 △ CaCl2+2H2O+2NH3↑
(5)因为氯气浓度较大,氨气密度较小,所以左边应通入氨气,右边通入氯气使二者混合均匀;
(6)整套装置从左向右的连接顺序是(j)….,说明装置左边是生成氨气的装置,经过碱石灰干燥通入D的f口中,产生的氯气经过饱和食盐水除杂、浓硫酸干燥,通入D的g口中,所以装置的连接顺序是(j)接(d)(e)接(f)(g)接(b)(c)接(h)(i)接(a)。
考点:考查实验装置的连接及作用,氨气的制取化学方程式的书写


科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
2014年世界环境日中国主题为“向污染宣战”,下列有关环境污染的叙述错误的是( )
A.大气污染主要指CO、SO2、氮氧化物以及粉尘等
B.氮氧化物是造成光化学烟雾的主要原因
C.臭氧可以杀菌消毒,空气中的臭氧含量越高,对人体健康越有利
D.酸雨通常是指pH在5.6以下的降水
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市六校高三5月第三次诊断性考试理综化学试卷(解析版) 题型:选择题
雌二醇和炔雌醇是两种雌激素用药,它们的结构简式如下,关于它们的说法不正确的是

A.核磁共振氢谱峰数相同
B.均能发生加成反应、取代反应、消去反应
C.两种分子中所有碳原子不可能在同一个平面内
D.可用FeCl3溶液鉴别
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:简答题
(13分)有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4且A不能使Br2的CCl4溶液褪色;1molB反应生成了2molC.

请回答下列问题:
(1)C→E的反应类型为____________
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.0%,则由A合成H的总产率为____________
(3)A的结构简式为___________________·
(4)写出C与银氨溶液反应的离子方程式为____________________________________
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为__________________
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为____________
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.1mol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I﹣+2Cl2=2Fe3++4Cl﹣+I2
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O
C. AlCl3溶液中加入过量氨水:Al3++4OH﹣=AlO2﹣+2H2O
D.向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH﹣+3H+=Ag++2NH4++H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:填空题
(15分)下表是元素周期表的一部分,请参照①~⑥在表中的位置,用化学用语回答下列问题:
| I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 |
|
| ① | ② | ③ | ④ |
|
|
3 |
|
|
|
| ⑤ |
| ⑥ |
|
(1) ⑥有两种同位素,其中一种原子核内有18个中子,其原子符号为_______;
(2)②与④可以形成一种温室气体,其电子式为_______;
(3) ③和⑤的氢化物沸点 __________(填分子式)高,原因是______________;
(4)②和⑥按原子个数比为1:4形成的化合物为_______分子(填极性或非极性),含有_______键(填极性或非极性)
(5) ②形成的单质可以是不同类型的晶体,它们可能是____________(填字母)
A原子晶体 B分子晶体 C金属晶体 D离子晶体 E.混合型晶体
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+ 2Pb2+(aq)+ H2O(l) 2PbCrO4(s)+ 2H+(aq)△H<0
2PbCrO4(s)+ 2H+(aq)△H<0
该反应达平衡后,改变条件,下列说法正确的是
A.移走部分PbCrO4固体,Cr2O72-转化率升高
B.升高温度,该反应的平衡常数(K)增大
C.加入少量NaOH固体,自然沉降后,溶液颜色变浅
D.加入少量K2Cr2O7固体后,溶液中c(H+)不变
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:填空题
氮、磷、锌、铁等是与生命活动密不可分的元素。请回答下列问题:
(1) NH3和PH3都是极性分子,其中极性较大的是______,理由是 。
(2) 20mL0.1 mol·L-1次磷酸(H3PO2)溶液与20 mL 0.1 mol·L-1 NaOH溶液恰好中和生成正盐,则H3PO2的结构式是 。
(3) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式
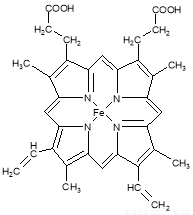

血红素中N原子的杂化方式为 ,在右图的方框内用“→”标出Fe2+的配位键。
(4) N2与CO互为等电子体。下表是两者的键能
数据(单位:kJ·mol-1):
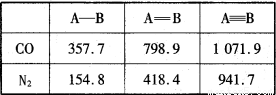
结合数据说明CO比N2活泼的原因:_____。
(5) Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com