
【题目】已知:![]()
![]() 根据以上热化学方程式,下列判断 不 正 确的是
根据以上热化学方程式,下列判断 不 正 确的是
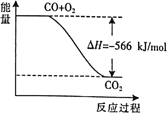
A.上图可表示由CO生成![]() 的反应过程和能量关系
的反应过程和能量关系
B.CO的燃烧热![]()
C.![]()
D.![]() 与
与![]() 反应放出
反应放出![]() 热量时,电子转移数为
热量时,电子转移数为![]()
科目:高中化学 来源: 题型:
【题目】黄铜是人类最早使用的合金之一,主要由锌和铜组成。回答下列问题:
(1)铜原子核外电子共有__种不同运动状态,基态铜原子的核外占据最高能层电子的电子云轮廓图形状为__。
(2)根据铜、锌原子结构可知第二电离能I2(Zn)__I2(Cu)填“大于”或“小于” 。
(3)向蓝色硫酸铜溶液[Cu(H2O)4]2+中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4]2+。
①H2O分子中心原子的杂化类型为__;分子中的键角:H2O__NH3(填“大于”或“小于”)。
②通过上述实验现象可知,与Cu2+的配位能力:H2O__NH3(填“大于”或“小于”)。
③氨硼烷(BH3—NH3)可以作为机动车使用的备选氢来源或氢储存的材料。
下列与氨硼烷是等电子体的有__(填编号)。
A.乙烷 B.H2O2 C.H3PO4 D.S8
④写出BH3—NH3的结构式 结构中若含配位键用→表示 __。
(4)某磷青铜晶胞结构如图所示。
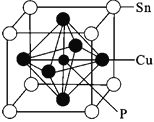
①其化学式为__。
②若晶体密度为8.82g/cm3,最近的Cu原子核间距为__cm(用NA表示阿伏加德罗常数,用M表示该晶体的摩尔质量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,甘氨酸在水溶液中主要以 、
、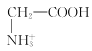 和
和![]() 三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
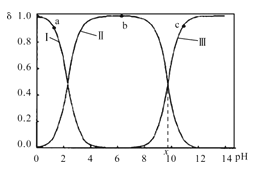
A.a点溶液中,水的电离程度大于b点
B.c点溶液中,c(![]() )>c(
)>c( )
)
C.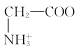 +H2O
+H2O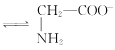 +H3O+的平衡常数为x
+H3O+的平衡常数为x
D.a点溶液中,存在关系式:c(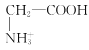 )+c(H+)=c(
)+c(H+)=c(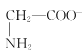 )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 与
与![]() 互为同位素
互为同位素
B.O2和O3互为同素异形体,两者之间不能相互转化
C.乙醇和甲醚互为同分异构体,可用金属钠鉴别
D.![]() 的一氯代物只有2种(不考虑立体异构)
的一氯代物只有2种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量______;
②若B、C都不是气体,气体的平均相对分子质量______;
③若B是气体,C不是气体,气体的平均相对分子质量______;
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是__________态,C的状态是__________态。
(3)某密闭容器中放入一定量的NO2,发生反应2NO2![]() N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是_________。
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是_________。
A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚有下列说法:

①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③该化合物可以发生取代反应、加成反应、加聚反应、氧化反应
④![]() 该化合物最多可与4mol H2或1molBr2发生加成反应。其中正确的是( )
该化合物最多可与4mol H2或1molBr2发生加成反应。其中正确的是( )
A. ①③B. ①②④C. ②③D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
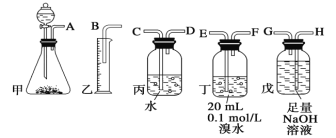
(1)电石制备乙炔气体的化学方程式____________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体通常用_______________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________;
(5)若没有装置戊,测定结果将会______(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)____;
(6)干燥乙炔可用_____________(填选项);
A. 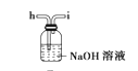
B.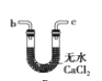
C.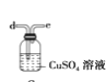
D.
(7)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:纯净乙炔气 ![]() 混合液
混合液 ![]() 有机混合物Ⅰ
有机混合物Ⅰ ![]() 混合液
混合液 ![]() 有机混合物Ⅱ
有机混合物Ⅱ
①操作b的名称是________;
②有机混合物Ⅰ可能含有的物质是________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2H2(g)+02(g)=2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是

A. H1<0 B. H2为该反应的反应热
C. H3为氢气的燃烧热 D. H1=H3-H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥司他韦是一种高效、高选择性神经氨酸酶抑制剂,是目前治疗流感的最常用药物之一,是公认的抗禽流感、甲型H1N1等病毒最有效的药物之一。也是国家的战略储备药物。也有专家尝试使用奥司他韦作为抗新型冠状病毒(2019-nCoV)药物。以莽草酸作为起始原料是合成奥司他韦的主流路线。
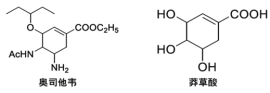
Ⅰ.莽草酸是从中药八角茴香中提取的一种化合物,是合成奥司他韦的原料。下列有关莽草酸说法正确的是__
A 不能使酸性高锰酸钾溶液褪色
B 可以发生加成反应、消去反应、加聚反应、缩聚反应、取代反应
C 分子中所有原子共平面
D 只溶于苯等有机溶剂,不溶于水
Ⅱ.奥司他韦的合成路线如下:
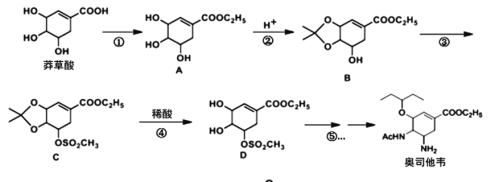
已知:![]()
回答下列问题:
(1)化合物A的含氧官能团名称有:_______,反应③的反应类型:____。
(2)反应①的反应试剂和反应条件:____。
(3)请写出反应②的化学方程式:____。
(4)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有__种。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。C中有__个手性碳。
(6)结合以上合成路线设计由对甲基苯甲醛制备对醛基苯甲酸![]() 的合成路线____。
的合成路线____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com