
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| A、C(s)+H2O(g)═CO(g)+H2(g)△H=-131.2 kJ?mol-1 |
| B、H2燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ?mol-1 |
| C、2H2O(g)═2H2(g)+O2(g)△H=-483.4 kJ?mol-1 |
| D、H2O(g)═H2O(l)△H=-44.1 kJ?mol-1 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:| c(H2)?c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 容器 | 实验1 | 实验2 | 实验3 |
| 反应物投入量(始态) | 1mol CO2、3mol H2 | 1mol CH3OH、1mol H2O | 2mol CH3OH、2mol H2O |
| CH3OH的平衡浓度/mol?L-1 | C1 | C2 | C3 |
| 反应的能量变化 | 放出 x kJ | 吸收y kJ | 吸收z kJ |
| 体系压强/Pa | P1 | P2 | P3 |
| 反应物转化率 | a1 | a2 | a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、只有③ |
| C、只有①② | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇燃料电池容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源.如图是甲醇的质子交换膜型燃料电池模型,下列有关说法正确的是( )
甲醇燃料电池容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源.如图是甲醇的质子交换膜型燃料电池模型,下列有关说法正确的是( )| A、Y极为电池的负极 |
| B、X极的电极反应式CH3OH+H2O-6e-=CO2+6H+ |
| C、若常温下以该电池电解100mLKCl溶液至PH=12时,电池质子交换膜迁移的A为0.01mol |
| D、空气以20%为氧气计算,X极每消耗1mol甲醇,Y极必消耗168L空气中的氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O、Na2O2组成元素相同,推出与水反应产物也完全相同 |
| B、SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强 |
| C、H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO |
| D、根据铜与浓硫酸可以制取SO2,推出常温下铁与浓硫酸也可以制取SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol C2H6分子中共含7NA个共价键 |
| B、25℃时,1mL纯水中含水10-10NA个OH-离子 |
| C、当NO2溶于水产生1molNO时,反应转移的电子数为2NA |
| D、标准状况下,22.4L三氧化硫所含的氧原子数等于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有③ | B、只有① |
| C、①② | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A.平衡常数与转化率关系: | 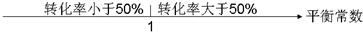 |
| B.Cl2与CH4取代反应后的产物: |  |
| C.25℃时,不同pH值的溶液中,水的电离度: |  |
| D.AlCl3 和NaOH反应铝元素的存在形式: |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com