
| A. | 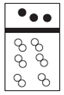 | B. | 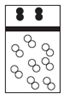 | C. | 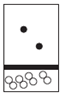 | D. | 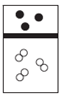 |
分析 白球代表氢原子,黑球代表氦原子,等质量的氢气与氦气,其物质的量之比为2:1,体积之比为2:1.
解答 解:设氢气与氦气都为mg,则二者的物质的量之比为$\frac{mg}{2g/mol}$:$\frac{mg}{4g/mol}$=2:1,则体积之比为2:1;
A、白球代表氢原子,黑球代表氦原子,符合物质的量之比为2:1,体积之比为2:1,故A正确;
B、白球代表氢原子,黑球代表氦原子,物质的量之比为2:1,体积之比为2:1,但氦气是单原子构成的分子,故B错误;
C、白球代表氢原子,黑球代表氦原子,物质的量之比为2:1,但体积之比为1:2,故C错误;
D、白球代表氢原子,黑球代表氦原子,物质的量之比为1:1,体积之比为2:1,故D错误;
故选A.
点评 本题考查阿伏伽德罗定律,明确等质量的气体中物质的量和体积的关系是解答的关键,并注意氦气的构成来解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定含有NH4+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| D | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
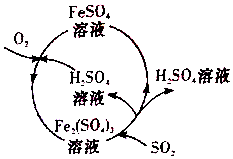 含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )| A. | 该过程中可得到化工产品H2SO4 | |
| B. | 该工艺流程是除去煤燃烧时产生的SO2 | |
| C. | 该过程中化合价发生改变的元素为Fe和S | |
| D. | 图中涉及到的反应之一为Fe2(SO4)3+SO2+2H2O═2FeSO4+2H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
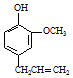 丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图.
丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图. .
.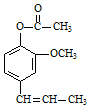 →A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(
→A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(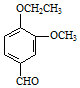 )
)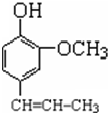 +CH3CH2Cl$\stackrel{一定条件}{→}$
+CH3CH2Cl$\stackrel{一定条件}{→}$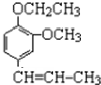 +HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.
+HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
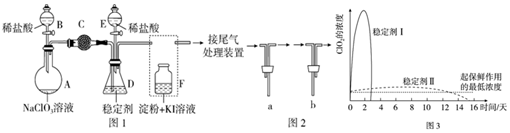
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, |
| K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
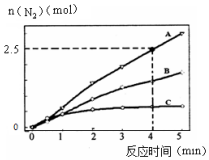 I.用NH3催化还原NxOy可以消除氮氧化物的污染.
I.用NH3催化还原NxOy可以消除氮氧化物的污染.| 温度/K | 反应① | 反应② | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
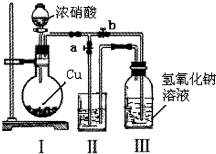 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com