
【题目】分子式为C5H10O2的酯共有(不考虑立体异构)( )
A.7种
B.8种
C.9种
D.10种
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】阅读相关信息,结合所学知识,回答下列问题:
(1)铝和锌都是两性金属元素。其氢氧化物都是白色沉淀,既能溶于强酸,又能溶于强碱(生成AlO2-或ZnO22-)。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
①写出锌和氢氧化钠溶液反应的化学方程式_________________________________。
②用氨水除去Al(OH)3中的Zn(OH)2的离子方程式为__________________________。
③写出向AlCl3溶液中滴入过量氨水的离子方程式___________________________;
向ZnCl2溶液中逐滴滴入氨水直至过量的现象是___________________________。
④下列各组中的两种溶液,只用胶头滴管和试管即可鉴别的是________________。
A.硫酸铝和氢氧化钠 B.硫酸铝和氨水
C.硫酸锌和氢氧化钠 D.硫酸锌和氨水
(2)Cu2O是一种红色难溶于水的固体,在空气中灼烧Cu2O会生成CuO;Cu2O溶于稀硫酸可生成Cu和Cu2+;Cu2O和Cu都能溶于稀硝酸。
研究性学习小组为检测Cu样品中是否含有Cu2O设计以下实验方案:
方案Ⅰ:取该红色样品溶于足量的稀硝酸中,观察是否有残渣剩余
方案Ⅱ:取该红色样品溶于足量的稀硫酸中,观察溶液颜色变化
方案Ⅲ:称量a g红色样品,在空气中充分灼烧至恒重,得到bg黑色固体。
①比较方案Ⅰ和方案Ⅱ,你认为合理的是方案_________(填“Ⅰ”或“Ⅱ”),合理方案的反应原理为________________________________________(用离子方程式表示)。
②方案Ⅲ中,如果 < b < (用含a的代数式表示)____________,可确认红色粉末含有Cu2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了制取纯净干燥的气体A,可用下图所示装置,生成A的速度可通过滴入液体B的速度控制。

①若A是能使带火星的木条复燃的气体,C物质是淡黄色粉末,且不需要Ⅲ装置,则A是______(填化学式),写出烧瓶中发生反应的化学方程式并用双线桥法标出电子得失情况:________________。
②若A可以灭火,C为块状不溶性固体,则A物质是________(填化学式,下同),D物质是__________,烧瓶中发生反应的的离子方程式为_____________________________________。
(2)某学生若用上图所示装置,一次实验即可确定HCl、H2CO3、H2SiO3的酸性强弱(不必选其他酸性物质),则E中发生反应的的离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯化镁和氯化铝的200 mL 混合溶液中,c(Mg2+)为 0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为( )
A. 40 mL B. 72 mL C. 80 mL D. 128 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I甲、乙、丙、丁分别是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3- 离子中的两种组成,可以发生如图转化:
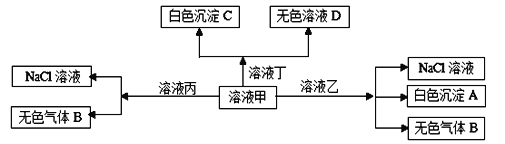
(1)写出无色气体B的一种用途_____________________________。
(2)甲与乙反应的离子方程式为:____________________________。
(3)白色沉淀A可能溶解在溶液D中,其溶解的化学方程式为:________________。
II无水NiCl2在有机合成中有着极为重要的作用,工业上常用含镍原料所制得的NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制得,已知SOCl2能与水反应生成SO2和HCl。写出NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制无水NiCl2的化学方程式___________________________________,NiCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水的原因是________________________________。
III锰及其化合物用途广泛。锰的化合物有60多种,其中以二氧化锰(MnO2)最稳定。将固体草酸锰(MnC2O4·2H2O)放在一个可以称出质量的容器里加热。固体质量随温度的变化关系如图所示,则:214 ℃时,剩余固体的成分为___________(填化学式); 943 ℃时,剩余固体的成分为__________(填名称)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,0.1mol/L某一元酸HA的水溶液PH=4.下列描述不正确的是( )
A.该溶液中HA有0.1%发生了电离
B.此酸电离平衡常数约为10﹣7
C.升高温度后溶液的PH增大
D.若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com