
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响。设计实验方案如下:
甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小。
实验装置如图,实验时分液漏斗中A溶液一次性放入B溶液中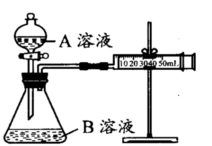
(注:实验中所用KMnO4溶液均已加人相同量H2SO4):
| 序号 | A溶液 | B溶液 |
| ① | 2 mL 0.1mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
| ② | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
| 时间(min) | 4 | 8 | 12 | 16 | 21 | 22 | 23 | 24 | 25 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 | 0.16 | 0.13 |
| υ(KMnO4) (10-4mol/(L·min) | υ | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 | 0.07 | 0.03 |
| 实验步骤及结论: |
(共17分)
(1)关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好。(2分)
(2)2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O(2分)
(3)浓度(1分) 秒表(1分)
比较在该环境中,相同时间收集到的气体体积,多的反应速率快(或比较在该环境中,比较收集相同体积气体所用时间,越短速率越快)(2分)
(4)0.11(3分)
①反应过程中产生了催化剂加快了反应速率(如果答生成的Mn2+对反应有催化作用也给分)(2分:
(或其他合理答案也给分)实验步骤及结论:(答案合理即可)
实验步骤:首先,取两支试管分别加入等体积上述酸性KMnO4溶液;接下来,向其中一支试管中加入少许MnSO4固体;最后,同时分别向两支试管中加入等体积的上述H2C2O4溶液,观察两支试管中颜色褪去的时间长短。(2分)
结论:若加有MnSO4固体试管褪色时间短,则证明是生成的Mn2+作催化剂。(2分)
解析试题分析:本题以课本实验为基础,探究影响化学反应速率的因素,首先应该联系课本知识,了解影响化学反应速率的因素有哪些以及氧化还原知识,实验基本操作等基础知识,然后运用恰当的方法进行解题。
(1)考查气密性的检查,在这个相对密封的体系,打开分液漏斗,开始用液体流下,后停止,并保持,说明气密性良好或通过活塞的推动,也可判断;
(2)氧化还原反应方程式的书写
(3)从改变的条件看,H2C2O4浓度从0.1到0.2mol/L,故为浓度对化学反应速率的影响;
(4)根据相关数据可以计算出速率的大小;从数据看出反应的速率先增大后减小,故可以考虑催化剂的影响。
考点:以探究实验为基础,考查影响化学反应速率的因素、化学实验基本操作、氧化还原反应基础知识等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
将N2和 H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:
(1)反应前混合气体中N2和 H2的体积比;
(2)达到平衡时混合气体中的氨的体积分数;
(3)平衡时N2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
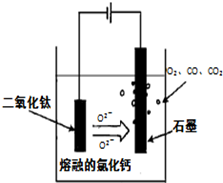
(14分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如图,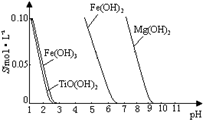
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因 是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下: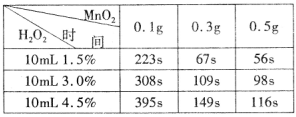
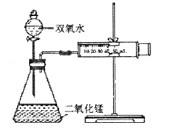
分析表中数据回答下列问题,
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而____________。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入_____g的二氧化锰为较佳选择。
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确_______理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫代硫酸钠(Na2S2O3)俗称大苏打,照相业中用作定影剂。Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成。
(1)Na2S2O3溶液与稀硫酸混合反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5 mL):
| 实验编号 | T/K | c(Na2S2O3)/ mol·L-1 | c(H2SO4)/ mol·L-1 | 实验目的 |
| ① | 298 | 0.1 | 0.1 | 实验①和②探究温度对该反应速率的影响;实验①、③和④探究反应物浓度对该反应速率的影响 |
| ② | 308 | | | |
| ③ | | 0.2 | | |
| ④ | | 0.1 | |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管中,加蒸馏水溶解 | |
| 步骤2: | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 | 铁的质量/g | 铁的 形态 | V(H2SO4) /mL | c(H2SO4) /mol·L-1 | 反应前溶液 的温度/℃ | 金属完全消 失的时间/s |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某学习小组设计如下实验方案,相关推测不合理的是
| A.试管②滴入酚酞后溶液可能变浅红 |
| B.试管③滴入FeCl3溶液后有红褐色沉淀生成 |
| C.试管④中的变化是物理变化 |
| D.上述反应说明Fe(OH)3溶解性小于Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
己知25℃时,Ksp(AgCl) =1.8×10-10,Ksp(AgBr) =5.4×10-13,Ksp(AgI) =8.5×10-17。某溶液中含有C1-、Br-和I-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
| A.C1-、Br-、I- | B.Br-、C1-、I- |
| C.I-、Br-、C1- | D.Br-、I-、C1- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com