
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 一种工业合成氨的简式流程图如下: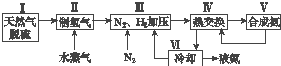
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
(2)步骤Ⅱ中制氢气的原理如下:①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.4 kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 .
a.升高温度b.增大水蒸气浓度 c.加入催化剂d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量.若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO的转化率为 .
(3)图(a)表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数: .
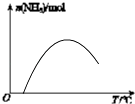
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图 . 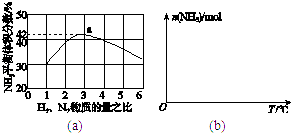
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) . 简述本流程中提高合成氨原料总转化率的方法:
【答案】
(1)2NH4HS+O2=2S↓+2NH3?H2O
(2)a;90%
(3)14.5%
(4)
(5)Ⅳ;分离液氨,未反应的氮气和氢气循环使用
【解析】解:(1)H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,说明又生成一水合氨,化学方程式为:2NH4HS+O2=2S↓+2NH3H2O;所以答案是:2NH4HS+O2=2S↓+2NH3H2O;(2)对于反应①正反应为气体体积增大吸热反应:a.反应是吸热反应,升高温度,反应速率增大,平衡正向进行,平衡体系中H2百分含量增大,故a符合;b.增大水蒸气浓度,平衡正向进行,反应速率增大,但平衡体系中H2百分含量不一定增大,故b不符合;c.加入催化剂,改变反应速率不改变化学平衡,反应速率增大,氢气百分含量不变,故c不符合;d.降低压强,反应速率减小,平衡逆向进行,氢气百分含量减小,故d不符合;若1mol CO和H2的混合气体(CO的体积分数为20%)中 CO为0.2mol,H2的物质的量为0.8mol,与H2O反应,得到1.18mol CO、CO2和H2的混合气体,设转化的一氧化碳的物质的量为x,则: CO(g)+H2O(g)CO2(g)+H2(g)
起始量(mol)0.2 0 0.8
变化量(mol)x x x
平衡量(mol)0.2﹣x x x+0.8
则0.2﹣x+x+x+0.8=1.18,解得x=0.18,则CO转化率为 ![]() ×100%=90%,
×100%=90%,
所以答案是:a;90%;(3)a点氮气的体积分数为42%,氢气与氮气物质的量之比为3:1,二者按3:1反应,平衡时二者体积分数之比为3:1,则平衡时氮气体积分数为(1﹣42%)× ![]() =14.5%,所以答案是:14.5%;(4)随反应进行氨气物质的量增大,达到平衡状态,合成氨的反应是放热反应,继续升温,平衡逆向进行,氨气物质的量减小,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图为:
=14.5%,所以答案是:14.5%;(4)随反应进行氨气物质的量增大,达到平衡状态,合成氨的反应是放热反应,继续升温,平衡逆向进行,氨气物质的量减小,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图为:  ,
,
所以答案是:  ;(5)合成氨为放热过程,通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,使合成氨放出的能量得到充分利用;
;(5)合成氨为放热过程,通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,使合成氨放出的能量得到充分利用;
将氨气液化,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率,所以答案是:Ⅳ;分离液氨,未反应的氮气和氢气循环使用.
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡的计算的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的叙述中正确的是( )
A. 元素周期表有7个周期和18个族
B. 由短周期元素和长周期元素共同组成的族一定是主族
C. 从左向右数第13列是第ⅢB族
D. 元素周期表中0族元素的单质全部是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应: 
下列有关三聚氰酸的说法正确的是( )
A.分子式为C3H6N3O3
B.分子中既含极性键,又含非极性键
C.属于共价化合物
D.生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)下图为四种粒子的结构示意图,完成以下填空: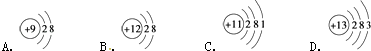
属于阳离子结构的粒子是(填字母序号,下同);A粒子的半径B粒子的半径(填“>”、“<”或“=”).
(2)有机物M经过太阳光光照可转化成N,转化过程如下: 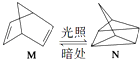 △H=+88.6kJmol﹣1则M、N相比,较稳定的是 .
△H=+88.6kJmol﹣1则M、N相比,较稳定的是 .
(3)由氢气和氧气反应生成1mol水蒸气放出热量241.8kJ,写出该反应的热化学方程式为: .
(4)一定温度下在某定容容器中发生反应:2A(g)+3B(g)2C(g),开始时,A的浓度为2molL﹣1 , B的浓度为4molL﹣1 , 2min后,A的浓度减少0.8molL﹣1 , 则①v(B)= , v(C)= .
②在2min末,C的浓度是 , B的浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是
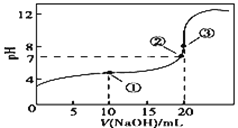
A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-)
C. 该滴定过程可选择甲基橙作为指示剂
D. 溶液中②、③点水的电离程度:③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫酸分解磷尾矿[主要成份为Ca5(PO4)3F]可制得中强酸磷酸H3PO4。请回答:
(1)Na2HPO4溶液呈碱性,则在该溶液中c(H2PO4-)_____c(PO43-)(填“>”、“<”、“=”),向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从电离平衡移动角度分析):________________________。
(2)Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
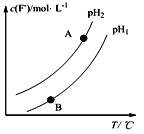
则:适当______温度有利于磷尾矿转化为羟基磷灰石(填“升高”、“降低”);pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F—的速率v(A)____v(B)(填“>”、 “<”、“=”);
(3)已知:25℃时,H3PO4的电离平衡常数:K1=7.52×10-3;K2=6.23×10-8;K3=6.23×10-13,则:H3PO4(aq)+OH-(aq)![]() H2PO4-(aq)+H2O (l)的平衡常数K=____________。
H2PO4-(aq)+H2O (l)的平衡常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列叙述中正确的是( )
A.泰国银饰和土耳其彩瓷是“一带一路”沿线国家的特色产品,其主要成分均为金属材料
B.从石墨中剥离出的石墨烯薄片能导电,因此是电解质
C.二氧化硫和氨气都易液化,液氨常用作制冷剂
D.生理盐水可用于养殖场消毒,以杀死H7N9等病毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3 , 装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3 , 与过量Cl2反应生成PCl5和HCl,遇O2会生成POCl3 , POCl3溶于PCl3 , PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | ﹣112 | 75.5 |
PCl5 | 2 | 105.3 |
请回答下列问题
(1)装置中制氯气的离子方程式为
(2)B中的试剂是 , E中次冷水的作用是 , F中碱石灰的作用是
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2 , 再迅速加入黄磷.通干燥CO2的作用是通过控制K1、K2能除去A、B装置中的空气,具体的方法是
(4)粗产品含有POCl3、PCl3等,加入黄磷加热除去PCl5 , 通过(填实验操作的名称),即可得到纯净的PCl3
(5)通过下面方法可测定产品中PCl3的质量分数.①迅速称取100g产品,加水反应后配成250mL溶液;
②取以上溶液25.0mL,向其中加入0.1mol 10mL碘水,充分反应;③向②所得溶液中加入几滴淀粉溶液,用0.1mol/L的Na2S2O3溶液滴定,滴定终点现象是
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.已知H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2SO4根据以上数据,该产品中PC3的质量分数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 合金的熔点一般比各成分金属的熔点高
B. 生铁的硬度比纯铁的硬度大
C. 胶体区别与其他分散系的本质特征是能发生丁达尔现象
D. 因为氯气溶于水可以导电,所以氯水是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com