
【题目】研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如图。下列说法不正确的是( )
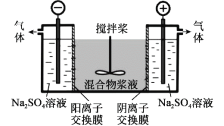
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.适当增大电压,CrO![]() 也可在阴极室转化为Cr(OH)3除去
也可在阴极室转化为Cr(OH)3除去
C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离
D.CrO![]() 通过阴离子交换膜进入阳极室,从而实现与浆液的分离
通过阴离子交换膜进入阳极室,从而实现与浆液的分离
【答案】B
【解析】
电解时,CrO42通过阴离子交换膜向阳极移动,在阳极氢氧根离子失电子发生氧化反应,OH放电后,阳极池酸度增强,发生反应2CrO42+2H+=Cr2O72+H2O,阴极发生还原反应生成氢气和NaOH,以此解答该题。
A.阳极发生氧化反应,该电极的电极反应式为:2H2O - 4e-= O2↑+4H+,故A正确;
B.适当增大电压,电解时,右池为阳极,阴离子向阳极移动,CrO42通过阴离子交换膜向阳极移动,从而CrO42-能从浆液中分离出,故B错误;
C.阴极发生还原反应生成氢气,同时还会得到硫酸钠、氢氧化钠,Al(OH)3和MnO2中的氢氧化铝可以溶于氢氧化钠,氢氧化钠可用于固体混合物Al(OH)3和MnO2的分离,故C正确;
D.电解时,CrO42-通过阴离子交换膜向阳极移动,通电后CrO42-将通过阴离子膜进入阳极室,从而实现与浆液的分离,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】石油是一种重要的资源。A~F是常见有机物,它们之间的转化关系如图1所示(部分产物和反应条件已略去),其中A的产量可以用来衡量一个国家的石油化工发展水平,E是最简单的芳香烃。回答下列问题:

(1)步骤②所用试剂X为___________(写化学式),D的官能团名称是_______;
(2)F的结构简式为________________,步骤①的反应类型:___________;
(3)写出下列步骤中的化学方程式(注明反应条件):
步骤③_____________________________________;
步骤④_______________________________________;
(4)用图2所示实验装置制取乙酸乙酯。请回答:试管b中所装溶液应为_____,乙酸乙酯生成后,分离出产品时的操作方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质,处理含重金属元素废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如图:

已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是___。
(2)检验“水洗”操作滤液中是否含Cl-,的正确操作是___。
(3)沉淀时常用冰水控制温度在0℃左右有利于提高CaO2·8H2O产率,其可能原因是(写出两种)①___;②___。
(4)测定产品中CaO2含量的实验步骤:
第一步:准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,
再滴入少量2mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液
VmL。(已知:I2+2S2O32-=2I-+S4O62-)
①CaO2的质量分数为___(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能___(填“不变”、“偏低”或“偏高”),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度
B. 若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C. 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D. 已知I:反应H2(g)+Cl2(g)=2HCl(g);△H=-a kJ/mol
II: ![]()
且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a+b+c)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
(1)反应A(g)+B(g)![]() C(g)+D(g),反应过程中能量变化如下图所示,回答下列问题:
C(g)+D(g),反应过程中能量变化如下图所示,回答下列问题:

①化学反应中产生能量变化的本质原因是____________________________________________;
②该反应是_____反应(填“吸热或放热”),ΔH=__________ (用E1、E2表示);
③加入催化剂对该反应的ΔH是否有影响?___________。
(2)已知:2CH3OH(l)+2O2(g)![]() 2CO(g)+4H2O(g) ΔH1=-a kJmol-1,2CO(g)+O2(g)
2CO(g)+4H2O(g) ΔH1=-a kJmol-1,2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-b kJmol-1;H2O(g)
2CO2(g) ΔH2=-b kJmol-1;H2O(g)![]() H2O(l) ΔH3=-c kJmol-1。则表示CH3OH(l)燃烧热的热化学方程式为___________________________________________。
H2O(l) ΔH3=-c kJmol-1。则表示CH3OH(l)燃烧热的热化学方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为________________
②该反应的热化学方程式为_____________________
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1,Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH2,Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1,则ΔH2=____________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=_______kJ·mol-1。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_________________。
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1
②4P(红磷,s)+5O2(g)===2P2O5(s)ΔH2
比较反应中ΔH的大小:ΔH1_______ΔH2(填“>”、“<”或“=”)。
(4)已知:稀溶液中,H+(aq)+OH﹣(aq)===H2O(l)ΔH=﹣57.3 kJ![]() ,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,A的溶解度是Sg·100g-1,其饱和溶液密度为dg·cm-3、物质的量浓度为cmol·L-1。溶液的质量分数为w,A的摩尔质量为Mg·mol-1,实验测得向一定量含A的溶液中加入mg无水A或蒸发掉ng水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )
A.S=![]()
B.c=![]()
C.S=![]()
D.c%=![]() 100%
100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com