
某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到实验目的的是( )
A.将铜丝插入浓硫酸中并加热,把反应后的溶液倒入水中,观察硫酸铜溶液的颜色
B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体
D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿
科目:高中化学 来源: 题型:
判断正误(正确打“√”,错误的打“×”,并改正)
(1)Na2S  ( )
( )
(2)Na2O 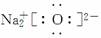 ( )
( )
(3)MgBr2 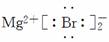 ( )
( )
(4)H2O 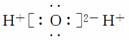 ( )
( )
(5)OH- 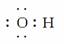 ( )
( )
(6)HClO 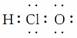 ( )
( )
(7)Cl2 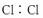 ( )
( )
(8)O
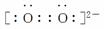 ( )
( )
(9)羟基 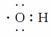 ( )
( )
(10)H2S 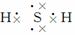 ( )
( )
(11)Na+ 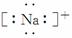 ( )
( )
(12) ( )
( )
查看答案和解析>>
科目:高中化学 来源: 题型:
用0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )

A.22.30 mL B.22.35 mL
C.23.65 mL D.23.70 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计 ②容量瓶 ③滴定管 ④烧杯 ⑤圆底烧瓶 ⑥量筒 ⑦玻璃棒
(1)在仪器上具体标明使用温度的是(不考虑温度计)______(填写编号,下同);可作反应容器并可加热的是______(填写编号)。
(2)需要用到温度计的实验是________。
①用乙醇170 ℃脱水制乙烯 ②石油分馏
③浓硫酸稀释 ④测定硝酸钾的溶解度
(3)玻璃棒的作用主要有以下三种:①搅拌 ②引流 ③蘸取溶液。不同实验中其作用可能不完全相同,请回答下列问题:
A.在“用无水碳酸钠配制100 mL 0.12 mol·L-1的碳酸钠溶液”的实验中,玻璃棒的作用是________。
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO 等杂质离子以获得纯净的食盐”的实验中玻璃棒的作用可能是________。
等杂质离子以获得纯净的食盐”的实验中玻璃棒的作用可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
合金与纯金属制成的金属材料相比,优点是( )
①合金的硬度一般比它的各成分金属的大
②一般地,合金的熔点比它的各成分金属的更低
③改变原料的配比、改变生成合金的条件,得到有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛
A.②③④ B.①②③⑤
C.①②④ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是________,产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是__________________________________________
________________________________________________________________________。
(3)③中所发生的各反应的离子方程式是____________________________________
________________________________________________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为__________,c(Fe2+)为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70% Cu、25% Al、4% Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
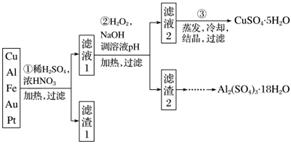
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为____________________________________________
________________________________________________________________________;
得到滤渣1的主要成分为____________。
(2)第②步加H2O2的作用是______________,使用H2O2的优点是______________;调溶液pH的目的是使______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是___________________________。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
甲: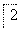
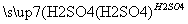
 ,蒸发、冷却、结晶、过滤
,蒸发、冷却、结晶、过滤
Al2(SO4)3·18H2O
乙: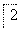
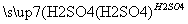

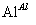

,蒸发、冷却、结晶、过滤Al2(SO4)3·18H2O
丙: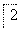
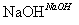

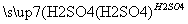

,蒸发、冷却、结晶、过滤Al2(SO4)3·18H2O
上述三种方案中,________方案不可行,原因是________________________________
________________________________________________________________________;
从原子利用率角度考虑,__________方案更合理。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多
C.一样多 D.无法比较
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com