
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| B. | 土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 | |
| C. | 水泥、冶金厂常用高压电除去工厂烟尘,减少对空气的污染 | |
| D. | 氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体 |
分析 A.血液透析的原理类似于渗析原理,透析膜相当于半透膜的作用;
B.胶体带电荷;
C.工厂烟尘属于气溶胶,胶体具有电泳性质;
D.氯化铝溶液中加入小苏打溶液会发生双水解反应.
解答 解:A.血液透析的原理类似于渗析原理,透析膜相当于半透膜的作用,肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗,故A错误;
B.胶粒带电荷,能吸附带相反电荷的离子,可用胶体的知识解释,故B错误;
C.工厂烟尘属于气溶胶,用高压电除去工厂烟尘是应用了胶体的电泳性质,故C错误;
D.氯化铝溶液中加入小苏打溶液会发生双水解反应而产生白色沉淀,不能用胶体知识解释,故D正确.
故选D.
点评 本题考查胶体的性质,要求学生熟记教材中提到的胶体的例子,是对基础内容的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| C. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| D. | 由热化学方程式H2(g)+F2(g)═2HF(g)△H=-270 kJ/mol可知2 L氟化氢气体分解成1 L的氢气和1 L的氟气吸收270 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
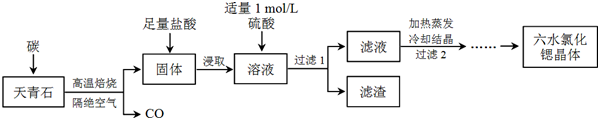
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离产生的c(H+)=10-12 mol/L的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 在c(H+)=$\sqrt{{K}_{W}}$mol/L的溶液中:K+、Fe3+、HCO3-、AlO2- | |
| C. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、SO42-、Cl- | |
| D. | pH=13的溶液中:NH4+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水与稀盐酸反应:H++OH-═H2O | |
| B. | FeCl3溶液与铁反应:Fe3++Fe═2Fe2+ | |
| C. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| D. | KOH稀溶液中通入过量的SO2:SO2+OH-═HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
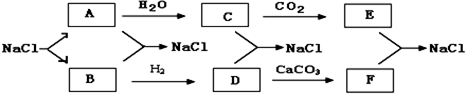
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com