
 以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
| ||
| 3.2g |
| 64g/mol |
| ||
| 3.2g |
| 64g/mol |


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
| A、1 mol Cl-离子中含有的电子数为8nA |
| B、标准状况下,2.24 L H20中含有的分子数为nA |
| C、27g铝与足量的氧气反应,转移的电子数为3nA |
| D、0.2 mo1?L-1 Ca(NO3)2溶液中含有的N03-离子数为0.4nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 |
| B、电池放电后,电池中溶液的pH变大 |
| C、电池充电时,阴极反应为:Pb-2e-+SO2-4=PbSO4 |
| D、电池充电时,把铅蓄电池的正极与外电源负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:
| 电解质 | 平衡方程式 | 平衡常数K | ||||||
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | ||||||
| H2CO3 | H2CO3?H++HCO
HCO
|
K1=4.31×10-7 K2=5.61×10-11 | ||||||
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | ||||||
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 |
- 3 |
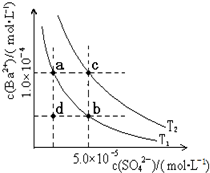
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素置X、Y、R、Q在元素周期表中的位置如图所示,其中Q元素是地壳中含量最高的元素.
短周期元素置X、Y、R、Q在元素周期表中的位置如图所示,其中Q元素是地壳中含量最高的元素.| 浓度/mol?L-1 时间/min |
NO | N2 | RO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1.
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、H+、Cl- |
| B、K+、OH-、CO32- |
| C、CO32-、OH-、Cl- |
| D、K+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | ||
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||
C、实验室用液溴和苯在催化剂作用下制溴苯: +Br2 +Br2
 +HBr +HBr | ||
| D、硝酸银溶液中滴加过量氨水:Ag++NH3?H2O═AgOH↓+NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com