


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光Br2 |
| NaOH、醇△ |
| 溴水 |
| NaOH、水 |
| O2、催化剂Cu |
| 一定条件 |
| 1,2-乙二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沉淀溶解达到平衡时,溶液中各离子的浓度一定相等 |
| B、沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C、难溶电解质的溶解平衡是一种动态平衡,可以通过改变条件使平衡移动 |
| D、沉淀转化的实质就是沉淀溶解平衡的移动,一般说来,溶解度小的沉淀转化成溶解度大的沉淀更容易实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、混合物中含有0.5molFeS |
| B、混合物中含有0.1mol FeO |
| C、参加反应的HNO3为1mol |
| D、氧化产物Fe3+为0.15mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KSCN |
| B、BaCl2 |
| C、AgNO3 |
| D、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
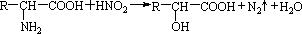
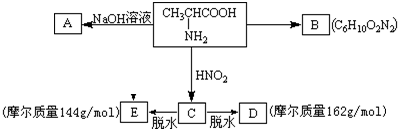
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3?H2O) |
| B、浓度为0.1 mol?L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、将pH=3的盐酸溶液和pH=11的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com