
| A. | KNO3 | B. | K2CO3 | C. | HNO3 | D. | Na2SO4 |
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:解答题
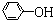 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子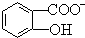 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是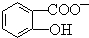 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
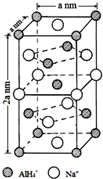 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
.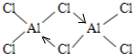 (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 将潮湿的NH3通过盛有无水CaCl2的干燥管 | 除去NH3中的水蒸气 |
| B | 往铁和稀硝酸反应后的溶液中滴入KSCN溶液 | 验证溶液中是否含有Fe3+ |
| C | 甲基橙作指示剂,用标准NaOH溶液滴定盐酸至红色 | 测量盐酸物质的量浓度 |
| D | 向2ml0.2mol/L的AgNO3溶液中先后滴加0.2mol/L 的NaCl溶液、KBr溶液各5滴 | 确定AgCl、AgBr的Kap的相对大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 阳极生成1.5mol Cl2 | B. | a=3 | ||
| C. | 电解后溶液中c(H+)=1moL/L | D. | 阴极析出的金属是铜与铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
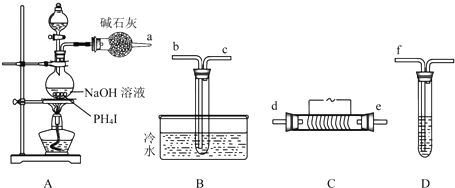
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 g D218O中含有的质子数为NA | |
| B. | 标准状况下,22.4 L NH3分子含有的杂化轨道数为4 NA | |
| C. | 78 g Na2O2晶体中所含阴、阳离子个数均为2 NA | |
| D. | 1 mol Fe完全溶于一定量的硝酸溶液中,转移的电子数一定是3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com