

 .
. ;⑤n CH2=CHCH2COOH$\stackrel{催化剂}{→}$
;⑤n CH2=CHCH2COOH$\stackrel{催化剂}{→}$ .
. .
.分析 某芳香族化合物A的水溶液显酸性,遇FeCl3不显色,说明含有酚羟基,A不饱和度=$\frac{11×2+2-12}{2}$=6,A能发生水解反应生成B、C,则A中含有酯基,B酸化得到G,则B为 ;
;
C酸化得到H,H具有酸性,则H中含有羧基,H在浓硫酸、加热条件下得到I、J,I和J互为同分异构体,I为
五元环状化合物;J可使溴水褪色,
H能自身发生酯化反应,则E中含有羧基和羟基,由A的分子式及G的结构简式知,H中含有4个碳原子,结合I为五元环状化合物,可以确定H的结构简式为:HOCH2CH2CH2COOH,I为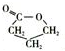 ,J的结构简式为CH2=CHCH2COOH,J在一定条件下发生加聚反应生成K为
,J的结构简式为CH2=CHCH2COOH,J在一定条件下发生加聚反应生成K为 ,C的结构简式为:HOCH2CH2CH2COONa,则A的结构简式为
,C的结构简式为:HOCH2CH2CH2COONa,则A的结构简式为 ,H在一定条件下发生缩聚反应生成L为:
,H在一定条件下发生缩聚反应生成L为: ,据此解答.
,据此解答.
解答 解:某芳香族化合物A的水溶液显酸性,遇FeCl3不显色,说明含有酚羟基,A不饱和度=$\frac{11×2+2-12}{2}$=6,A能发生水解反应生成B、C,则A中含有酯基,B酸化得到G,则B为 ;
;
C酸化得到H,H具有酸性,则H中含有羧基,H在浓硫酸、加热条件下得到I、J,I和J互为同分异构体,I为
五元环状化合物;J可使溴水褪色,
H能自身发生酯化反应,则E中含有羧基和羟基,由A的分子式及G的结构简式知,H中含有4个碳原子,结合I为五元环状化合物,可以确定H的结构简式为:HOCH2CH2CH2COOH,I为 ,J的结构简式为CH2=CHCH2COOH,J在一定条件下发生加聚反应生成K为
,J的结构简式为CH2=CHCH2COOH,J在一定条件下发生加聚反应生成K为 ,C的结构简式为:HOCH2CH2CH2COONa,则A的结构简式为
,C的结构简式为:HOCH2CH2CH2COONa,则A的结构简式为 ,H在一定条件下发生缩聚反应生成L为:
,H在一定条件下发生缩聚反应生成L为: ,
,
(1)A的结构简式: ,故答案为:
,故答案为: ;
;
(2)通过以上分析知,反应③属于消去反应,反应④属于缩聚反应,故答案为:消去;缩聚;
(3)反应②的化学方程式为: ,
,
反应⑤的化学方程式为:n CH2=CHCH2COOH$\stackrel{催化剂}{→}$ ,
,
故答案为: ;
;
n CH2=CHCH2COOH$\stackrel{催化剂}{→}$ ;
;
(4)G为对羟基苯甲酸,G的同分异构体符合下列条件:①含有苯环;②能发生银镜反应,不能发生水解,说明含有醛基但不含甲酯基;
③在稀NaOH溶液中,1mol该同分异构体能与2molNaOH反应;
④只能生成两种一氯代物,说明只有一种氢原子,
符合条件的同分异构结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物推断,侧重考查学生分析推断能力,根据G、H采用逆向推导的方法进行推断,知道常见有机反应条件及反应类型,难点是(4)题同分异构判断,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯(CH2=CH2)、苯(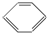 )、环己烷( )、环己烷(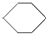 )都属于脂肪烃 )都属于脂肪烃 | |
| B. | 苯(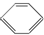 )、环戊烷( )、环戊烷( )、环己烷( )、环己烷(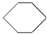 )同属于芳香烃 )同属于芳香烃 | |
| C. | 乙烯(CH2=CH2)、乙炔(CH≡CH)同属于烯烃 | |
| D. | 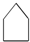 、 、 、 、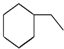 同属于环烷烃 同属于环烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷是共价化合物 | B. | 甲烷分子具有正四面体结构 | ||
| C. | 甲烷分子具有极性键 | D. | 甲烷分子中H-C-H的键角为90℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、R的简单离子具有相同的电子层结构 | |
| B. | X2Y的熔点和沸点均比X2W高,是因为X2Y的分子内存在氢键 | |
| C. | X、Z分别与Y均可形成AB与A2B2型化合物,且A2B2均有较强的氧化性 | |
| D. | 由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | ||
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | |
| 乙酸乙酯(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇和苯 | |
| B. | 用酸性高锰酸钾溶液鉴别乙烯和乙烷 | |
| C. | 用燃烧法鉴别乙醇和苯 | |
| D. | 用碳酸钠溶液鉴别乙醇和乙醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com