

 .
. .
. =O$→_{H+}^{ROH}$
=O$→_{H+}^{ROH}$
 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应.写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应.写出制备化合物  的最后一步反应的化学方程式
的最后一步反应的化学方程式 .
. 分析 (1)由结构简式可确定官能团,可用红外光谱检验;
(2)对比D、E的结构可知,D→E发生取代反应,由D、E的结构及X分子式确定X的结构;
(3)由D、E的结构可知,D→E发生取代反应;
(4)两分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,应是氨基与羧基之间发生脱水反应,两分子C脱去2分子水生成 ;
;
(5)B的同分异构体中,与B含有相同的官能团,苯环上的取代基不超过2个,则三个官能团可在同一个取代基,苯环有2个取代基,可有一个官能团与苯环直接相连,每种都有邻、间、对3种;
乙醇发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,再发生水解反应生成乙二醇,甲醇催化氧化生成HCHO,最后乙二醇与甲醛反应生成 .
.
解答 解:(1)由结构简式可知分子C中除氯原子外的官能团还有氨基、羧基,可检测红外光谱,故答案为:氨基、羧基;红外光谱;
(2)由D、E的结构可知,D→E发生取代反应,由D、E的结构及X分子式,可知X的结构简式为: ,故答案为:
,故答案为: ;
;
(3)由D、E的结构可知,D→E发生取代反应,故答案为:取代;
(4)两分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,应是氨基与羧基之间发生脱水反应,两分子C脱去2分子水生成 ,该反应方程式为
,该反应方程式为 ,
,
故答案为: ;
;
(5)B的同分异构体中,与B含有相同的官能团,苯环上的取代基不超过2个,则三个官能团可在同一个取代基,苯环有2个取代基,可有一个官能团与苯环直接相连,每种都有邻、间、对3种,共10种,除B外还有9种,
故答案为:9;
乙醇发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,再发生水解反应生成乙二醇,甲醇催化氧化生成HCHO,最后乙二醇与甲醛反应生成 ,涉及的反应类型有:消去反应、加成反应、氧化反应、取代反应,最后一步反应方程式为:
,涉及的反应类型有:消去反应、加成反应、氧化反应、取代反应,最后一步反应方程式为: ,
,
故答案为:①②③④; .
.
点评 本题考查有机物的推断与合成,为高频考点,侧重考查有机反应类型、同分异构体书写等,是对有机化学基础的综合考查,充分利用有机物的结构进行分析解答,较好的考查学生分析推理能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| Cl2的体积 (标准状况下)/L | 2.8 | 5.6 | 11.2 |
| n(A-)/mol | 1.25 | 1.5 | 2 |
| n(B-)/mol | 1.5 | 1.4 | 0.9 |
| n(C-)/mol | a | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. +
+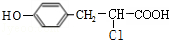 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;写出化合物EDA的电子式
;写出化合物EDA的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com