
【题目】下列叙述正确的是( )
A.分散质微粒直径介于1~10 nm之间的分散系称为胶体
B.Fe(OH)3胶体是纯净物
C.利用丁达尔现象可以区别溶液与胶体
D.胶体微粒不能透过滤纸
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. NaNO2溶液中加入酸性KMnO4溶液:2MnO4﹣+5NO2﹣+6H+═2Mn2++5NO3﹣+3H2O
B. 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3﹣+2OH﹣═CO32﹣+NH3H2O+H2O
C. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I﹣═2Fe2++I2
D. 用惰性电极电解熔融氯化钠:2Cl﹣+2H2O═Cl2↑+H2↑+2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】均由两种短周期元素组成的A、B、C三种化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4。A和C分子中,其原子个数比都为1:1,B分子中原子个数比为1:2。由两种短周期元素组成的双核D离子中含有10个电子,它与A、B分子均能反应,生成一种常见的10电子分子E。请回答下列问题:
(1)C的化学式为_____。A的还原性______B的还原性(填“大于”或“小于”)
(2)写出B与D在溶液中反应的离子方程式__________。
(3)气态的A分子遇到某10电子分子会产生白烟,请写出该白烟成分的电子式_______;该白烟的水溶液与浓的含D离子的溶液在受热条件下反应的离子方程式为_________。
(4)写出一个含有18电子的五原子分子的化学式_______,其中的一种元素形成的单质可被含D离子的溶液腐蚀,发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,氯离子浓度最大的是( )
A.1L 1mol/L NaCl溶液B.2L 1mol/L KCl溶液
C.3L 1mol/L AlCl3溶液D.1L 2mol/L NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+![]() Cr3++Fe3++H2O ②,下列有关说法正确的是
Cr3++Fe3++H2O ②,下列有关说法正确的是
A. 还原性:Cr3+>SO2 B. 配平后方程式②中,a=6,b=7
C. Cr2O72-能将Na2SO3氧化成Na2SO4 D. 方程式①中W为OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法正确的是
A. 1molCO2与SO3的混合气体氧原子数为2NA
B. 1mol/L KClO3溶液中含有NA个ClO3﹣
C. 标准状况下,11.2LCCl4所含的分子数为0.5NA
D. 25℃,1.01×105Pa,88gCO2中所含原子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
I.(配制酸性KMnO4标准溶液)如图是配制50 mL酸性KMnO4标准溶液的过程示意图。
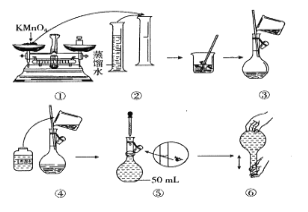
(1)请你观察图示判断其中不正确的操作有____(填序号)。
(2)其中确定50 mL溶液体积的容器是____(填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测的实验结果将_______(填“偏大”或“偏小”)。
II.(测定血液样品中Ca2+的浓度)抽取血样20. 00 mL,经过上述处理后得到草酸,再用0.020 mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL酸性KMnO4溶液。
(4)已知草酸与酸性KMn04溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mnx++10CO2↑+8H2O,则式中的x=____。
(5)滴定时,根据现象____,即可确定反应达到终点。
(6)经过计算,血液样品中Ca2+的浓度为____mg.cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com