
【题目】已知:氮气和氢气合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92kJ/mol。请回答下列问题:
2NH3(g) ΔH=-92kJ/mol。请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量____92kJ(填“大于”、“等于”或“小于”);若升高温度,上述反应中ΔH____(填“变大”、“变小”或“不变”)。
(2)已知:分别破坏1molN![]() H键、1mol H
H键、1mol H![]() H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N![]() N键需要吸收的能量为___________。
N键需要吸收的能量为___________。
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molNH3(g)并发生上述反应。半分钟后反应达到平衡,测得v(NH3)=0.40mol/(Lmin),则N2(g)+3H2(g)![]() 2NH3(g)反应的平衡常数为___________。
2NH3(g)反应的平衡常数为___________。
【答案】 小于 不变 946kJ 100/3(或33.3或100/3mol-2.L2或33.3mol-2.L2)
【解析】试题分析:(1)此反应是可逆反应,不能进行到底,因此放出的热量小于92kJ,△H只与始态和终态有关,与反应途径无关,因此△H不变;(2)根据△H和键能的关系,△H=(x+3×436-6×391)kJ·mol-1=-92kJ·mol-1,解得x=946;
(3) 2NH3(g)![]() N2(g)+3H2(g)
N2(g)+3H2(g)
起始:0.5 0 0
变化:0.4×0.5 0.1 0.3
平衡:0.3 0.1 0.3
K=c3(H2)×c(N2)/c2(NH3)=0.33×0.1/0.32=0.03,N2(g)+3H2(g)![]() 2NH3(g),K1=c2(NH3)/[c3(H2)×c(N2)]=1·K-1=100/3。
2NH3(g),K1=c2(NH3)/[c3(H2)×c(N2)]=1·K-1=100/3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料](NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)

实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________________。
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a.盛装0.2000mol/L NaOH溶液
b.用0.2000mol/L NaOH溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________。
(5)装置B内溶液吸收的气体是____________。
(6)(NH4)2SO4在400℃分解的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)W原子的核外电子排布式为_________。
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为_________、__________、_________,推测盐中阴离子的空间构型为__________,其中心原子杂化方式为__________。
(3)Z、W两种元素电负性的大小关系为____;Y、Z两种元素第一电离能的大小关系为____。
(4)CO的结构可表示为C![]() O,元素Y的单质Y2的结构也可表示为Y
O,元素Y的单质Y2的结构也可表示为Y![]() Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):

①结合数据说明CO比Y2活泼的原因:_____。
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是_____。

A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是短周期元素组成的中学常见的四种物质,它们之间有下图所示的转化关系。已知:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体。

请回答下列问题:
(1)写出B和C的化学式:B________,C________;
(2)写出A的电子式:____________;
(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是____________________;
(4)写出上图D→C的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组用下图所示装置制备少量溴苯并验证溴与苯的反应是取代反应。

实验时,关闭F活塞,打开C活塞,在装有少量苯的三口烧瓶中由A口加入少量液溴,再加入少量铁屑,塞住A口。
回答下列问题:
(1) D试管内装的是_________,其作用是__________________________。
(2) E试管内装的是________________。
(3) 除去溴苯中混有的Br2杂质的试剂是____________,操作方法为:__________。
(4) 三口烧瓶中发生反应的化学方程式为:_______________________________。
(5) 根据什么现象可证明验证溴与苯的反应是取代反应?__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成:
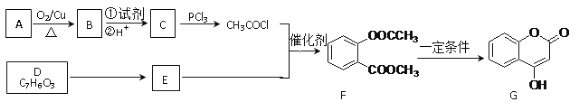
已知:RCOOH![]() RCOCl;D与FeCl3溶液能发生显色。
RCOCl;D与FeCl3溶液能发生显色。
请回答下列问题:
⑴B→C的转化所加的试剂可能是__________,C+E→F的反应类型是_______。
⑵有关G的下列说法正确的是_________。
A.属于芳香烃 B.能与FeCl3溶液发生显色反应
C.可以发生水解、加成、氧化、酯化等反应 D.1mol G最多可以跟4mol H2反应
⑶E的结构简式为_________。
⑷F与足量NaOH溶液充分反应的化学方程式为__________________________________。
⑸写出同时满足下列条件的E的同分异构体的结构简式_______________。
①发生水解反应②与FeCl3溶液能发生显色反应③苯环上有两种不同化学环境的氢原子
⑹已知:酚羟基一般不易直接与羧酸酯化。而苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_________________
)是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_________________
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越小
B. NaHCO3受热易分解,可用于制胃酸中和剂
C. 反应活化能越高,该反应越易进行
D. 锅炉水垢可先用Na2CO3处理,再用盐酸去除
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com