
| A. | 与等体积pH=11的氨水混合后所得溶液pH小于7 | |
| B. | 与pH=3的CH3COOH溶液混合后所得溶液pH小于3 | |
| C. | 与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 | |
| D. | 与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
分析 A.一水合氨为弱碱,pH=11的氨水浓度大于0.001mol/L,两溶液等体积混合后氨水过量,溶液显示碱性;
B.溶液pH相等,溶液中氢离子浓度相等,混合后溶液中氢离子浓度不变,醋酸和醋酸根离子浓度变化相等,醋酸的电离平衡不移动;
C.未知醋酸钠溶液体积,如果醋酸钠远远过量,反应后的溶液可能为碱性溶液;
D.根据酸碱中和反应实质及溶液酸碱性与溶液pH的关系进行计算;
解答 解:硫酸为强电解质,pH=3的硫酸溶液中氢离子浓度为0.001mol/L,
A.一水合氨为弱电解质,溶液中部分电离出氢氧根离子,pH=11氨水中氢氧根离子浓度为0.001mol/L,两溶液等体积混合后氨水过量,溶液显示碱性,溶液的pH大于7,故A错误;
B.醋酸与硫酸的pH相等,则两溶液混合后溶液中氢离子浓度不变,醋酸根离子与醋酸的浓度变化程度相等,混合后醋酸的电离平衡不移动,溶液的pH=3,故B错误;
C.如果醋酸钠远远过量,反应后生成醋酸和醋酸钠和硫酸钠的溶液,由于醋酸根离子水解程度大于醋酸的电离程度,则溶液显示碱性,溶液的pH大于7,故C错误;
D.10L Ba(OH)2溶液恰好完全反应,氢氧化钡中氢氧根离子的物质的量等于硫酸中氢离子的物质的量,其物质的量为:0.001mol,则Ba(OH)2溶液中氢氧根离子浓度为:$\frac{0.001mol}{10L}$=0.0001mol/L,溶液的pH等于10,故D正确;
故选D.
点评 本题考查了酸碱混合后的定性判断及溶液酸碱性与溶液pH的计算,题目难度中等,注意明确溶液酸碱性与溶液pH的关系,选项C为易错点,注意合理分析溶液中氢离子浓度变化情况.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
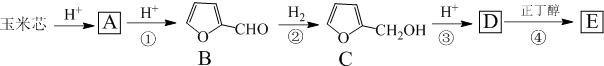
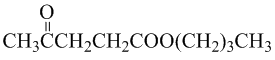 .
.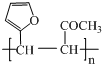 .写出反应的化学方程式
.写出反应的化学方程式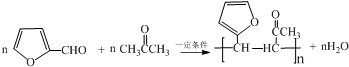 (不必注明反应条件).
(不必注明反应条件).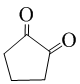 或
或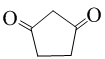 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 600mL 18.4mol/L H2SO4 | B. | 100mL 1mol/L HCl | ||
| C. | 200mL 80% HNO3 | D. | 600mL 0.1mol/L HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com