
| A. | 工业制金属钠:电解饱和食盐水 | |
| B. | 工业制溴:某些植物有富集溴的能力,从海产品中提取溴是工业上获取溴的重要途径 | |
| C. | 冶炼铝:电解Al2O3,同时加入冰晶石(Na3AlF6),目的是为了降低Al2O3熔融温度 | |
| D. | 硫酸工业:在氧气充足的情况下,从接触室进入吸收塔的气体中不可能含有SO2 |
分析 A.工业电解饱和食盐水生成NaOH、氢气、氯气;
B.溴主要存在于海水中,碘主要富集在海水植物中;
C.电解熔融Al2O3生成Al和氧气;
D.二氧化硫与氧气反应为可逆反应,依据可逆反应特点解答.
解答 解:A.工业电解饱和食盐水生成NaOH、氢气、氯气,电解熔融的氯化钠可得到钠和氯气,故A错误;
B.溴主要存在于海水中,碘主要富集在海水植物中,海水提溴是工业上获取溴的重要途径,故B错误;
C.电解熔融Al2O3生成Al和氧气,加冰晶石(Na3AlF6)是作助熔剂,降低氧化铝熔融时的温度,故C正确;
D.二氧化硫与氧气反应为可逆反应,可逆反应反应物不能完全转化为生成物,存在反应限度,故D错误;
故选:C.
点评 本题考查了金属的冶炼与海水提溴、工业制取浓硫酸,熟悉金属活泼性顺序、海上提溴过程、可逆反应特点是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
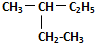 和
和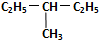 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 运液氯可用钢瓶装,车上应贴 标志.装运浓硫酸可用铝槽罐车,应贴 标志.装运浓硫酸可用铝槽罐车,应贴 标志 标志 | |
| B. | 冬天严禁在窗门紧闭的室内用煤饼炉取暖,因为生成的CO、SO2等容易引起中毒 | |
| C. | 用铝锅煮菜一般在起锅之前才放盐,既减少加碘盐的损耗,又能增加铝锅的使用寿命 | |
| D. | 严禁在写作业时将铅笔放入口中啃咬,否则会引起铅中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
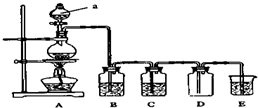 如图是实验室中制备气体或验证气体性质的装置图.
如图是实验室中制备气体或验证气体性质的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以使甲基橙变红的溶液中:Fe3+、Al3+、Cl-、H2O2 | |
| B. | 由水电离产生的H+浓度为1×10-13mol•L-1的溶液中,Na+、K+、Cl-、HCO3- | |
| C. | 强碱性的溶液中:CO32-、Na+、[Al(OH)4]-、NO3- | |
| D. | 酸性溶液中:Fe3+、Al3+、NO3-、C6H5O- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com