




 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O. .
.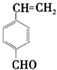 和
和 .
. 分析 有机物X与HCHO发生信息i的反应,结合A的分子式为C4H8O2可知,X为CH3CH2CHO,A为HOCH2CH(CH3)CHO,A发生消去反应脱去1分子H2O生成B,故B为CH2═C(CH3)CHO,B氧化生成C为CH2═C(CH3)COOH;Y与甲醛在碱性条件下生成D,D与氢气加成得E,由信息iii中N的结构及E和G反应生成N可知,E为 ,G为
,G为 ,根据转化关系,可逆推得Y为CH3CHO,Z为
,根据转化关系,可逆推得Y为CH3CHO,Z为 ,故F为
,故F为 ,D为
,D为 ,根据信息ii中反应,结合M的分子式C21H28O8可知,M的物质为
,根据信息ii中反应,结合M的分子式C21H28O8可知,M的物质为 ,据此解答.
,据此解答.
解答 解:有机物X与HCHO发生信息i的反应,结合A的分子式为C4H8O2可知,X为CH3CH2CHO,A为HOCH2CH(CH3)CHO,A发生消去反应脱去1分子H2O生成B,故B为CH2═C(CH3)CHO,B氧化生成C为CH2═C(CH3)COOH;Y与甲醛在碱性条件下生成D,D与氢气加成得E,由信息iii中N的结构及E和G反应生成N可知,E为 ,G为
,G为 ,根据转化关系,可逆推得Y为CH3CHO,Z为
,根据转化关系,可逆推得Y为CH3CHO,Z为 ,故F为
,故F为 ,D为
,D为 ,根据信息ii中反应,结合M的分子式C21H28O8可知,M的物质为
,根据信息ii中反应,结合M的分子式C21H28O8可知,M的物质为 ,
,
(1)由上述分析可知,A为HOCH2CH(CH3)CHO,含有羟基、醛基,A→B是HOCH2CH(CH3)CHO发生消去反应脱去1分子H2O生成CH2═C(CH3)CHO,
故答案为:羟基、醛基;消去反应;
(2)由上述分析可知,Z的结构简式是 ,名称是苯甲醛,故答案为:苯甲醛;
,名称是苯甲醛,故答案为:苯甲醛;
(3)M的物质为 ,1molM在一定条件下发生加成反应,最多消耗 4molH2,故答案为:4;
,1molM在一定条件下发生加成反应,最多消耗 4molH2,故答案为:4;
(4)B为CH2═C(CH3)CHO,由B生成C的反应①的化学方程式为 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O,
+Cu2O↓+3H2O,
故答案为: +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O;
+Cu2O↓+3H2O;
(5)Y为CH3CHO,由Y生成D的化学方程式为CH3CHO+3HCHO$\stackrel{OH-}{→}$ ,故答案为:CH3CHO+3HCHO$\stackrel{OH-}{→}$
,故答案为:CH3CHO+3HCHO$\stackrel{OH-}{→}$ ;
;
(6)G为 ,G的同分异构体仍含有C=C和-CHO,符合条件的同分异构体有如下4种:
,G的同分异构体仍含有C=C和-CHO,符合条件的同分异构体有如下4种: 、
、 、
、 、
、 ,其中
,其中 和
和 核磁共振氢谱有5组峰值,且峰值比为2:2:2:1:1的结构简式,
核磁共振氢谱有5组峰值,且峰值比为2:2:2:1:1的结构简式,
故答案为:4; 和
和 .
.
点评 本题考查有机推断与合成,学生充分利用给出的反应信息及有机物的结构、分子式确定X、E、G的结合是关键,难度较大,是对学生逻辑思维能力、自学能力等考查.


科目:高中化学 来源: 题型:选择题
| A. | H2在Cl2中燃烧会产生苍白色火焰 | |
| B. | 氯水用于漂白表现了HClO的强氧化性 | |
| C. | 漂粉精是混合物,其有效成分是次氯酸钠 | |
| D. | 漂粉精放入稀酸中可以提高漂白速度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图.
(1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
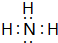 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3,H2SO4,KOH | B. | BaCl2,NaOH,KHCO3 | ||
| C. | AgNO3,HNO3,NaBr | D. | FeCl3,HNO3,Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

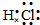 ,甲的组成元素的原子结构示意图
,甲的组成元素的原子结构示意图 ,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)
,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com