
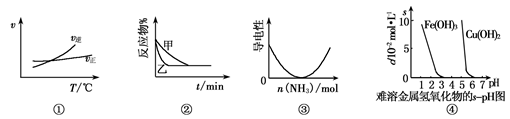
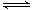 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0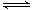 3C(g)的影响,甲的压强大
3C(g)的影响,甲的压强大

科目:高中化学 来源:不详 题型:填空题
 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)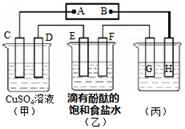
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是| A.①② | B.④ | C.③ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
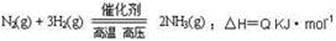
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgNO3 | B.NaNO3 | C.Mg(NO3)2 | D.Al(NO3)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原电池是将化学能转化成电能的装置 |
| B.原电池的负极发生氧化反应 |
| C.图中a极为镁条、b极为锌片时,导线中会产生电流 |
| D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
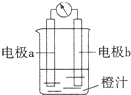
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
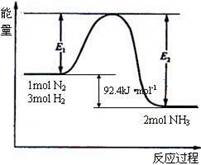
 2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。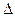 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1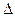 H2=" —771.1" kJ·mol-1
H2=" —771.1" kJ·mol-1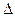 H3=" 482.2" kJ·mol-1
H3=" 482.2" kJ·mol-1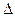 H= kJ·mol-1。
H= kJ·mol-1。 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。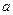 的代数式表示NH3·H2O的电离常数Kb= 。
的代数式表示NH3·H2O的电离常数Kb= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.4.0g碳化硅晶体中所含C—Si数为0.4NA |
| B.PCl3、BF3、HClO这些分子中每个原子都达到了8电子结构 |
| C.电解精炼铜时,当阳极质量减少3.2 g时,电路中转移的电子数为0.1NA |
D.若H+(aq) + OH-(aq)= H2O(l);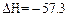 kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com