
【题目】某同学设计如图装置进行乙醇氧化反应的探究实验,有关说法不正确的是()
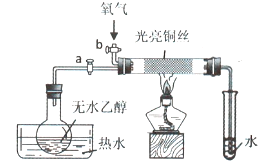
A.热水的作用是促使乙醇挥发,为硬质玻璃管内提供乙醇蒸汽
B.通入乙醇蒸汽反应的过程中,撤离酒精灯后反应仍能进行
C.在硬质玻璃管内发生的主反应为:![]()
D.实验结束时,先停止加热,再关闭活塞a、b,最后将导管移出水面
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
选项 | 实验目的 | 实验步骤及现象 |
A | 检验亚硫酸钠试样是否变质 | 试样 |
B | 检验某盐是否为铵盐 | 试样 |
C | 证明酸性条件下H2O2氧化性比I2强 | NaI溶液 |
D | 除去硝酸钾晶体中少量氯化钠 | 试样 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是__________________。
(2)A、B、C 三种元素的氢化物稳定性由强到弱的顺序为_________(用化学式表示)。
(3)A的最简单氢化物分子的空间构型为_______,其中A原子的杂化类型是________。
(4)A的单质中δ键的个数为_______________,π键的个数为_______________。
(5)写出基态E原子的价电子排布式:__________________________。
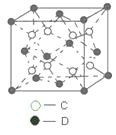
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,求晶胞边长a =________cm。(用ρ、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,向10mL0.10mol·L-1的一元弱酸HA(Ka =1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )

A.a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a点和b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A- )+c(OH-)
D.V =10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些资料表明:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析Na2O2和NO2都有氧化性,根据化合价升降原则提出如下假设:
假设Ⅰ. Na2O2氧化NO2; 假设Ⅱ. NO2氧化Na2O2。
请回答下列问题:
(1)甲同学设计如图1所示实验装置:
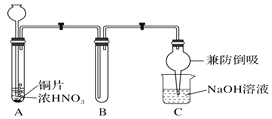
图1
①试管A中反应的离子方程式是___________________________________________________。
②待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。甲同学据此认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个装置,该装置的作用是__________________________________________________________________。
③乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的化学方程式是_____________________。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化,查阅资料知:
ⅰ) 2NO+Na2O2===2NaNO2;
ⅱ) 6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O;
ⅲ)酸性条件下,NO或NO![]() 都能与MnO
都能与MnO![]() 反应生成NO
反应生成NO![]() 和Mn2+。
和Mn2+。
丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应:
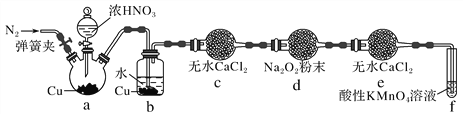
图2
①b装置中观察到的主要现象是__________________________________________________,f装置的作用是_________________________________________________________________。
②在反应前,先打开弹簧夹,通入一段时间N2,其目的是____________________________
③充分反应后,检验d装置中发生反应的实验是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或试剂的选择合理的是( )
A.焰色反应时需用稀硫酸洗净铂丝,并在火焰上灼烧至无色。
B.用湿润的pH试纸测得某碱性溶液的pH为13
C.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
D.用丁达尔效应可鉴别![]() 溶液和
溶液和![]() 胶体
胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题;
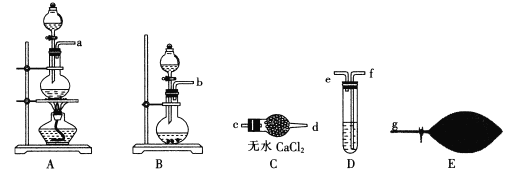
(1)为了配制模拟尾气,甲组同学用上图所示装置分别制备NO、乙烯及CO三袋气体。
①用装置A制取NO,分液漏斗中盛放的是___(填试剂名称)。
②用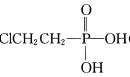 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
③用H2 C2 O4与浓硫酸制取CO(化学方程式为H2C2O4 ![]() CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
(2)乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO,CO,C2 H4及空气),按如图所示 装置进行尾气转化并检验。
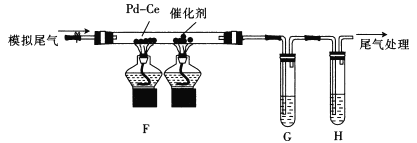
①为检验催化反应后的气体中是否有CO2生成和乙烯的残留,G、H中盛放的试剂依次是_________(填标号)。
a. NaOH溶液 b.酸性KMnO4溶液
c.澄清石灰水 d. Br2/CCl4溶液
②通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是___;写出其中CO与NO完全转化为无害气体的化学方程式:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、1.01×105Pa时,将3L炔烃和烷烃的混合气体与相同状况下的14LO2混合,充分燃烧后,恢复到原来状态时,所得气体的体积是17L。则该混合气体可能是下列各组中的( )
A.C2H4和C2H6B.C3H4和CH4C.C2H2和CH4D.C4H6和C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
Ⅰ.室温下,现有c(H+) 相同的醋酸甲和盐酸乙:
(1)相同条件下,取等体积的甲乙两溶液,各稀释100倍。稀释后的溶液,其c(H+) 大小关系为:
甲 _____________乙 (填“大于”“小于”或“等于”,下同)。
(2)各取25 mL的甲乙两溶液,分别与等浓度的NaOH稀溶液完全反应,则消耗的NaOH溶液的体积大小关系为V(甲) _____________ V(乙)。
Ⅱ.已知25 ℃时有关弱酸的电离平衡常数如下:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
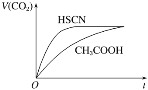
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 _____________。
(2)若保持温度不变,在醋酸溶液中通入一定量氨气,下列各量会变小的是 ______________(填字母)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
III.(1)HClO4H2SO4HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是 _________。
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO42-
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)亚磷酸是二元中强酸,25 ℃时亚磷酸(H3PO3)的电离常数为K1=1×10-2K2=2.6×10-7。
①试从电离平衡移动的角度解释K1为什么比K2大_______________________ 。
②写出亚磷酸的电离方程式(2步)_________________;_______________ 。
③请设计一种方案,使之能通过直观的实验现象判断醋酸的酸性强于H2S,该方案所用的试剂是 __________,反应的化学方程式为 _____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com