
【题目】已知某纯碱试样中含有 NaCl 杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
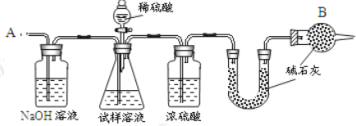
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的 U 形管的质量,得到 b g;
④从分液漏斗滴入 6 molL-1的硫酸,直到不再产生气体时为止;
⑤从导管 A 处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的 U 型管的质量,得到 c g;
⑦重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g;
请填空和回答问题:
(1)第一个洗气瓶中氢氧化钠溶液的作用是____________________
(2)装置中干燥管 B 的作用是_______________________________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)。
(4)步骤⑤的目的是_______________________________________
(5)步骤⑦的目的是_________________________________________
(6)该试样中纯碱的质量分数的计算式为________________________。
【答案】吸收空气中的CO2 防止空气中的二氧化碳和水气进入U型管中 偏高 把反应产生的二氧化碳全部导入U型管中 判断反应产生的二氧化碳是否全部排出,并被U型管中的碱石灰吸收 ![]()
【解析】
实验原理是通过准确测定和酸反应生成的二氧化碳气体的量,计算碳酸钠的量;盐酸的挥发性,空气中含有二氧化碳和水蒸气都会对实验产生干扰,据此回答。
(1)空气中含有二氧化碳,氢氧化钠溶液吸收二氧化碳,防止空气中的二氧化碳气体进入U型管中的碱石灰,干扰实验;
(2)U型管中的碱石灰是为了吸收反应生成的二氧化碳,但空气中也存在二氧化碳,干燥管B的作用就是防止空气中的二氧化碳和水分进入U型管,对结果产生误差。
(3)由于盐酸具有挥发性,也会随着二氧化碳进入U型管,被误认为是二氧化碳,所以二氧化碳的质量偏大,算出的碳酸钠的质量也会偏大的,所以结果会偏大。
(4)由于反应结束后锥形瓶中存留有二氧化碳,鼓入一定量的空气就是将残留的二氧化碳完全排入U型管;步骤⑤的目的是把反应产生的二氧化碳全部导入U型管中;
(5)U型管的质量基本不变,说明二氧化碳已经被全部排到U型管中;步骤⑦的目的是判断反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收;
(6)设需要碳酸钠的质量为X,则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X d-b
列比例式:![]()
解得X=![]() ;
;
所以试样中纯碱的质量分数的计算式为![]()
![]() ;
;


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A________,B________,C________,D________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是__________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性(除稀有气体外)最大的元素是_________。
(4)E元素原子的核电荷数是_________,E元素在周期表的第_______周期第_______族,在________区。
(5)写出D元素原子构成单质的电子式___________,该分子中有_______个σ键,_______个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“治污水”是“五水共治”工程中一项重要举措。
(1)某污水中的有机污染物为三氯乙烯 (C2HCl3),向此污水中加入一定浓度的酸性重铬酸钾(K2Cr2O7还原产物为Cr3+)溶液可将三氯乙烯除去,氧化产物只有CO2。写出该反应的离子反应方程式_____。
(2)化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样的COD。主要的实验装置、仪器及具体操作步骤如下:
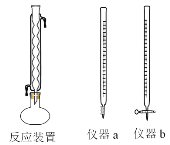
操作步骤:
Ⅰ量取20.00mL水样于圆底烧瓶中,并加入数粒碎瓷片;Ⅱ量取10.00mL重铬酸钾标准溶液中加入到圆底烧瓶中,安装反应装置(如上图所示)。从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应后停止加热。Ⅲ待反应液冷却后加入指示剂2滴,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。发生的化学反应方程式为Cr2O72-+14H++6Fe2+=6Fe3++2Cr3++7H2O。请回答:
①量取10.00mL重铬酸钾标准溶液用到的仪器是_______________(填仪器a或仪器b)。
②下列有关说法正确的是 _________________(用相应编号填写)。
A. 配制重铬酸钾标准溶液时所有需用到仪器有:天平(含砝码)、玻璃棒、烧杯和容量瓶
B. 滴定前锥形瓶、滴定管均需用蒸馏水洗后再用待取液进行润洗
C. 滴定时用左手控制旋塞,眼睛注视锥形瓶内液体颜色变化,右手摇动锥形瓶,使溶液向同一方向旋转
D. 加热回流结束后,未用蒸馏水冲洗冷凝管管壁,则滴定测得的硫酸亚铁铵体积偏小
③已知:重铬酸钾标准溶液的c(Cr2O72-)=0.02000mol·L-1,硫酸亚铁铵溶液的c(Fe2+)=0.01000 mol·L-1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为18.00mL,则按上述实验方法,测得的该水样的化学需氧量COD=_______mg/L。
(3)工业上常用铁炭(铁屑和活性炭混合物)微电解法处理污水。保持反应时间等条件不变,测得铁碳混合物中铁的体积分数、污水溶液pH对污水COD去除率的影响分别如图1、图2 所示。
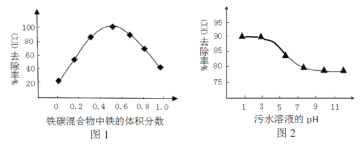
①由图1、图2可知下列推论不合理的是________________。
A. 活性炭对污水中的还原性物质具有一定的吸附作用
B. 酸性条件下,铁屑和活性炭会在溶液中形成微电池,铁为负极,溶液中有大量的Fe2+、Fe3+
C. 当铁碳混合物中铁的体积分数大于50%时,COD的去除率随着铁的质量分数增加而下降的主要原因是溶液中微电池数目减少
D. 工业降低污水COD的最佳条件为:铁的体积分数占50%;污水溶液pH约为3
②根据图2分析,COD的脱除率降低的原因可能为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮(![]() )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
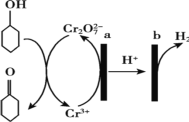
A.a 极与电源负极相连
B.a 极电极反应式是 2Cr3+- 6e- +14OH-= Cr2O72-+7H2O
C.b 极发生氧化反应
D.理论上生成 1mol 环己酮时,有 1molH2 生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g) H1=-134kJ·mol1
CH2ClCHClCH3(g) H1=-134kJ·mol1
II.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g)![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_____________________________。
(3)起始时向某恒容绝热容器中充入1mol CH2=CHCH3和1mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() ____________;反应I的平衡常数Kp=____________________kPa1(Kp为以分压表示的平衡常数,保留小数点后2位)。
____________;反应I的平衡常数Kp=____________________kPa1(Kp为以分压表示的平衡常数,保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.36g冰中含有氢键的数目为2NA
B.100g30%的甲醛水溶液中所含的氧原子数目为1NA
C.1molCl2与足量铁粉完全燃烧,转移的电子数为3NA
D.14gFe发生电化学腐蚀最终生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A 与 H2、CO 以物质的量 1∶1∶1 的比例形成 B,B能发生银镜反应,C 分子中只有一种氢,相关物质转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
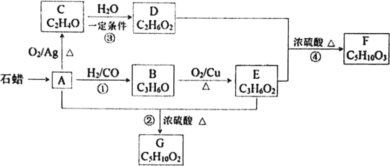
请回答:
(1)有机物 C 的结构简式是________,反应②的反应类型是________。
(2)写出一定条件下发生反应①的化学方程式___________。
(3)下列说法不正确的是________(填字母)。
A.化合物 A 属于烃
B.化合物 D 含有两种官能团
C.用金属钠无法鉴别化合物 F、G
D.A 与 D 一定条件下可以生成 CH3CH2OCH2CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应包含氧化还原反应
D.反应②的化学方程式为2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据原电池原理,回答下列问题:

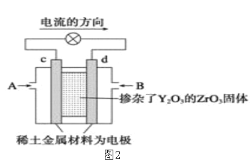
(1)图1是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料是________(填化学名称);电极Y的材料是__________(填化学名称)。
②Y电极发生的电极反应式为:______________。
(2)图2是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e―→2O2-)。
①c电极为______________极。(填“正”或“负”)
②d电极上的电极反应式为___________________________。
③如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为______________(用NA表示),需要消耗标准状况下氧气的体积为_______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com