
分析 (1)根据①CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ•mol-1
③2CO(g)+O2(g)?2CO2(g)△H3=-566.0kJ•mol-1
由盖斯定律①×2+②×2+③计算书写热化学方程式;
(2)根据平衡体系中各组分的体积分数相等,利用三段式结合平均反应速率v(CO)=$\frac{△c}{△t}$进行计算,平衡常数仅与温度有关,温度不变,平衡常数也不变;
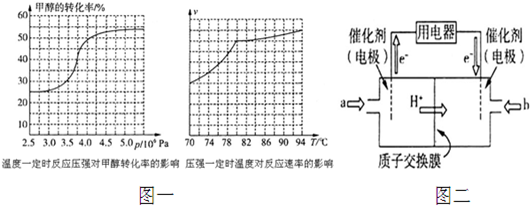
(3)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率较大的是4.0×106Pa;
②依据图象分析温度在高于80°C对反应速率影响不大,又反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大;
(4)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应;
②根据电解池的工作原理和电极方程式来计算.
解答 解:(1)根据①CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ•mol-1
③2CO(g)+O2(g)?2CO2(g)△H3=-566.0kJ•mol-1
由①×2+②×2+③得2CH4(g)+O2(g)?2CH3OH(g)△H,故△H=2△H1+2△H2+△H3=(+247.3kJ•mol-1)×2+(-90.1kJ•mol-1)×2+(-566.0kJ•mol-1)=-251.6kJ•mol-1,所以用CH4和O2直接制备甲醇蒸气的热化学方程式为2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1,
故答案为:2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1;
(2)CH4(g)+CO2(g)?2CO(g)+2H2(g)
起始(mol) 6 6 0 0
变化(mol) x x 2x 2x
平衡(mol)6-x 6-x 2x 2x
平衡体系中各组分的体积分数相等,所以6-x=2x,解得x=2,
则该反应在0~5min内的平均反应速率v(CO)=$\frac{△c}{△t}$=$\frac{\frac{2×2mol}{4L}}{5min}$=0.2mol•L-1•min-1;
又平衡常数仅与温度有关,温度不变,平衡常数也不变,所以在相同温度下,将上述反应改在某恒压容器内进行,该反应的平衡常数不变,
故答案为:0.2;不变;
(3)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率较大的是4.0×106Pa,故选:b;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
故答案为:高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低;
(4)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;CH3OH-6e-+H2O=CO2+6H+;
②用此电池以惰性电极电解饱和食盐水的电极反应为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,当两极共收集到标准状况下的气体1.12L(0.05mol)时,则生成氢氧化钠的物质的量是0.05mol,所以COH-=$\frac{0.05mol}{0.5L}$=0.1mol/L,所以pH=13,故答案为:13.
点评 本题考查了盖斯定律的应用、热化学方程式的计算书写、化学平衡的计算、图象分析判断以及电化学的知识等,注意掌握基础知识的掌握,题目难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 第9列元素中没有非金属元素 | |
| B. | 第17列为卤族元素 | |
| C. | 只有第2列元素原子的最外层有2个电子 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | M | |
| W |
| A. | 原子半径:W>Y>Z>M>X | |
| B. | 热稳定性:XM>X2Z,沸点:X2Z>YX3 | |
| C. | X、Y、Z三种元素形成的化合物中不可能含离子键 | |
| D. | ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向废液中加入少量的葡萄糖溶液,无红色沉淀产生,说明废液中不含Cu2+ | |
| B. | 向废液中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明废液中含有Cl- | |
| C. | 向废液中加少量铁粉,充分反应后无固体剩余,说明废液中含有Fe3+ | |
| D. | 向废液中滴加KSCN溶液,无现象,再加入氯水后溶呈血红色,说明废液中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 人造纤维、合成纤维和光导纤维都是新型无机非金属材料 | |
| C. | 氢氧化铝可用于制作治疗胃酸过多的药物 | |
| D. | “煤改气”、“煤改电”等改造工程有利于减少雾霾天气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Cl-、HCOOH、I-可以大量共存 | |
| B. | 与Na2SO3反应的离子方程式:ClO-+SO32-═SO42-+Cl- | |
| C. | 不可使用pH试纸测定该溶液的pH | |
| D. | 1 L 0.1 mol/L该溶液和足量的CO2充分反应,产生10 g沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )| A. | 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L (标准状况) | |
| B. | NO2转化为N2O4的转化率为20% | |
| C. | 容器甲中NO已反应完 | |
| D. | 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com