
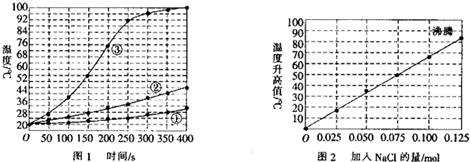
分析 (1)根据实验1中三组物质不同之处判断实验目的;
(2)结合图2可知,NaCl用量达到0.125 mol时,溶液达到沸腾状态,再增加NaCl的用量时,温度不再发生变化;
(3)根据图2当加入0.06 mol NaCl时记录的温度进行判断;
(4)根据镁粉、铁粉与NaCl水溶液共同构成了原电池的角度进行分析.
解答 解:(1)实验1中三组物质不同之处在于镁的状态,故实验1是研究的是镁的表面积与速率的关系,
故答案为:镁的表面积;
(2)根据图2可知,NaCl用量达到0.125 mol时,溶液已经达到沸腾状态,当NaCl的用量再增加时,温度不再发生变化,所以无需再做,所以C正确,
故答案为:C;
(3)由图2可见,当加入0.06 mol NaCl时,第15 min记录的温度升高值在42℃左右,所以则第15min时混合物的温度最接近于:42℃+20℃=62℃,则D正确,
故答案为:D;
(4)镁粉、铁粉与NaCl水溶液共同构成了原电池,大大促进了Mg的反应,加快了反应的速率,
故答案为:镁粉、铁粉与NaCl的水溶液构成了原电池,加快了反应速率.
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,注意掌握温度、固体表面积、浓度等影响化学反应速率的因素,(4)中注意构成原电池后对反应速率的影响,试题培养了学生的分析、归纳能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
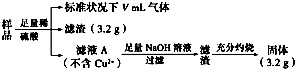
| A. | V=44.8 | |
| B. | 原样品中Fe元素的质量分数为38.89% | |
| C. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | |
| D. | 样品中CuO的质量为4.0 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 、
、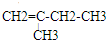 、
、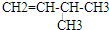 .
.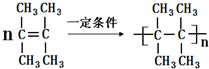 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | C2H5OH浓硫酸170℃共热, 制得气体通入酸性KmnO4溶液 | 检验制得气体是否为乙烯 |
| B | 向含有少量的FeBr2和FeCl2溶液中 加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
| C | 在淀粉溶液中滴加少量市售食盐配制的溶液 | 鉴别真假碘盐 |
| D | 银氨溶液中滴入少量组成为C2H4O2的液态 有机物,水溶微热,有银镜出现 | 不能确定该有机物一定是甲酸甲酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏属于物理变化 | |
| B. | 油脂在酸性或碱性条件下的水解反应叫做皂化反应 | |
| C. | 石油分馏得到的各馏分都是纯净物 | |
| D. | 淀粉和纤维素在一定条件下水解均可得到葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成4种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
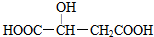 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 苹果酸能发生取代反应、消去反应和缩聚反应 | |
| C. | 1 mol苹果酸最多可与1 mol Na2CO3发生复分解反应 | |
| D. | 与苹果酸官能团种类和个数均相同的同分异构体还有两种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com