
碱式碳酸镁和无水氯化镁具有广泛的用途。
●用白云石(CaCO3?MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
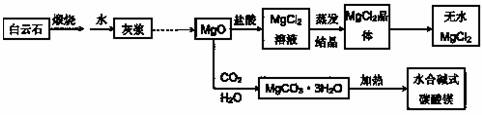
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:
(2)从MgCl2晶体得到无水MgCl2的操作为:
●为探究所制得的水合碱式碳酸镁(m MgCO3?n Mg(OH)2?x H2O)的组成。某同学组装仪器如图所示:
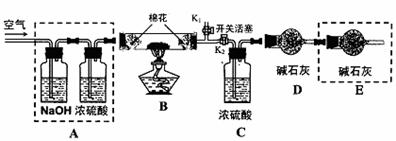
(3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:
(4)A框中装置的作用是 ;在装好试剂后,加热前应进行的操作是 。
(5)若将E框中的装置去掉,对实验结果m的值影响是 (填‘偏大’或‘偏小’或‘不变’)
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
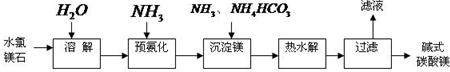
(14分)镁及其化合物在生产生活中有重要的作用。以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为 。指出该物质在工农业生产中的一种用途: 。
(2)写出预氨化时发生的主要反应的离子方程式: 。
(3)沉淀镁时反应的温度不宜过高,原因是 。
(4)设计一个实验,确定产品碱式碳酸镁aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③ ;④ ;⑤称量MgO。
18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a= ;b = ;c = 。
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁。有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则。你同意该同学的想法吗?为什么?你的观点是 。理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸镁和无水氯化镁具有广泛的用途。
●用白云石(CaCO3?MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
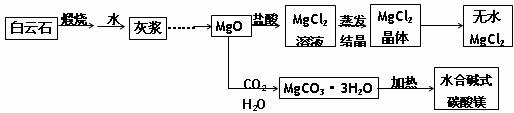
回答下列问题:
(1)“灰浆”中除水和MgO处,主要成分还有:_____________。
(2)从MgCl2晶体得到无水MgCl2的操作为:________________。
●为探究所制得的水合碱式碳酸镁(mMgCO3?nMg(OH)2?xH2O)的组成,某同学组装仪器如图所示:
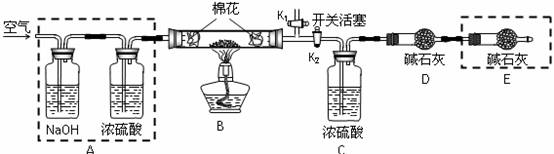 (3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,则此水合碱式碳酸镁的化学式为:______________。
(3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,则此水合碱式碳酸镁的化学式为:______________。
(4)A框中装置的作用是______________;在装好试剂后,加热前应进行的操作是_____。
(5)若将E框中的装置去掉,对实验结果的影响是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸镁和无水氯化镁具有广泛的用途。
●用白云石(CaCO3?MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
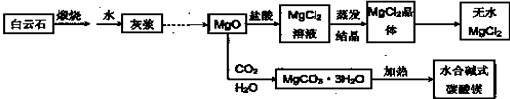
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:
(2)从MgCl2晶体得到无水MgCl2的操作为:
●为探究所制得的水合碱式碳酸镁(m MgCO3?n Mg(OH)2?x H2O)的组成。某同学组装仪器如图所示:
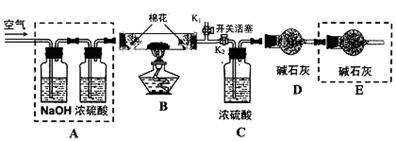
(3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:
(4)A框中装置的作用是 ;在装好试剂后,加热前应进行的操作是
。
(5)若将E框中的装置去掉,对实验结果的影响是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com