
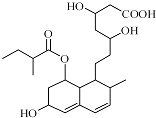
| A. | 该分子中有三种官能团 | B. | 能与FeCl3溶液发生显色反应 | ||
| C. | 能发生加成、取代、消去反应 | D. | 1mol该物质最多可与1molNaOH反应 |
分析 由结构简式可知,分子中含碳碳双键、-OH、-COOC-、-COOH,结合烯烃、羧酸、醇、酯的性质来解答.
解答 解:A.分子中含碳碳双键、-OH、-COOC-、-COOH四种官能团,故A错误;
B.不含酚羟基,所以不能和氯化铁发生显色反应,故B错误;
C.碳碳双键能发生加成反应、醇羟基和酯基及羧基能发生取代反应、醇羟基能发生消去反应,故C正确;
D.-COOH、-COOC-可与NaOH反应,则1mol该物质最多可与2mol NaOH反应,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、羧酸、醇及酯性质的考查,注意该物质中不含苯环,为易错点.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 向其中再加入少量醋酸钠晶体时,溶液中所有离子浓度都增大 | |
| B. | 离子浓度大小比较:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 向其中加入盐酸至恰好呈中性时,c(Na+)=c(CH3COO-) | |
| D. | 加水稀释时$\frac{c(C{H}_{3}C{O}^{-})}{c(N{a}^{+})}$的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | e=$\frac{1}{11.2}$mol•L-1、ω=$\frac{36.5}{224ρ}$% | B. | e=$\frac{1}{22.4}$mol•L-1、ω=$\frac{36.5}{224ρ}$% | ||
| C. | e=$\frac{1}{22.4}$mol•L-1、ω=$\frac{36.5}{112ρ}$% | D. | e=$\frac{1}{11.2}$mol•L-1、ω=$\frac{23}{224}$% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 操作 | 解释 | |
| A | 去除二氧化硫中的混有的二氧化碳 | 氯化钡溶液洗气 | 二氧化碳能与氯化钡溶液反应 |
| B | 提纯含氯化铁杂质的氯化钠 | 重结晶 | 氯化铁和氯化钠的溶解度随温度变化差异大 |
| C | 分离乙酸和乙酸乙酯的混合物 | 萃取 | 乙酸和乙酸乙酯的混合物静置分层 |
| D | 分离乙醇和水的混合物 | 蒸馏 | 两者互溶且沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④ | C. | ①②④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 63 g•mol-1 | B. | 122 g•mol-1 | C. | 40g•mol-1 | D. | 163 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量时,把Na2CO3固体直接放在托盘天平的右盘上 | |
| B. | 将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中 | |
| C. | 定容时如果加水超过了刻度,用胶头滴管直接吸出多余部分 | |
| D. | 配制溶液时容量瓶中有少量蒸馏水会影响实验结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有酯类和糖类都可以发生水解反应 | |
| B. | 分馏石油得到的各个馏分都是混合物 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 动物脂肪和植物油都属于酯类,都是高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com