
 回答下列有机化学问题:
回答下列有机化学问题: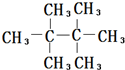 ;
;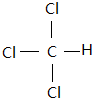 (写出一种).
(写出一种). 分析 C3H8的二溴代物中,两个溴原子可以连在一个碳原子上,也可以连在不同的碳原子上,共4种;乙烷中,六个氢原子被甲基取代,得到的物质为 ,依据连在同一个碳原子上的氢原子等效,处于对称位置上的氢原子等效,可知该烷烃一氯代物只有一种;1molCH4含有4molH,完全反应,共生成4molHCl;由图可知,三种原子,其中中间形成4条共价键为碳原子,较小的为氢原子,绿色的可能为氯原子,为三氯甲烷.
,依据连在同一个碳原子上的氢原子等效,处于对称位置上的氢原子等效,可知该烷烃一氯代物只有一种;1molCH4含有4molH,完全反应,共生成4molHCl;由图可知,三种原子,其中中间形成4条共价键为碳原子,较小的为氢原子,绿色的可能为氯原子,为三氯甲烷.
解答 解:C3H8的二溴代物中,两个溴原子可以连在一个碳原子上,也可以连在不同的碳原子上,共4种;乙烷中,六个氢原子被甲基取代,得到的物质为 ,依据连在同一个碳原子上的氢原子等效,处于对称位置上的氢原子等效,可知该烷烃一氯代物只有一种;1molCH4含有4molH,完全反应,共生成4molHCl;由图可知,三种原子,其中中间形成4条共价键为碳原子,较小的为氢原子,绿色的可能为氯原子,其分子的结构式为
,依据连在同一个碳原子上的氢原子等效,处于对称位置上的氢原子等效,可知该烷烃一氯代物只有一种;1molCH4含有4molH,完全反应,共生成4molHCl;由图可知,三种原子,其中中间形成4条共价键为碳原子,较小的为氢原子,绿色的可能为氯原子,其分子的结构式为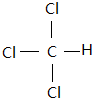 ;
;
故答案为:4; ;4;
;4;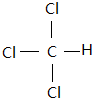 .
.
点评 本题考查了烷烃结构书写、一氯代物的判断,题目综合性强,明确一氯代物的判断方法及有机物的结构特点是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
 下列各组物质中,满足下图物质一步转化关系的选项是( )
下列各组物质中,满足下图物质一步转化关系的选项是( )| X | Y | Z | |
| A | Na | NaOH | NaHCO3 |
| B | S | SO3 | SO2 |
| C | Cu | CuO | CuSO4 |
| D | Si | SiO2 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 水俣病是因为长期食用富含汞的鱼和贝类而造成的慢性汞中毒 | |
| B. | 水俣病是长期食用含镉的污水灌溉的水稻造成的 | |
| C. | 日本的水俣病是有机汞引起的汞中毒 | |
| D. | 深海的生物对重金属离子的富集浓度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知热化学方程式如下:N2(g)+3H2O(1)═2NH3(g)+$\frac{3}{2}$O2(g);△H=+765.2kJ•mol-1,请在坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注.
(1)已知热化学方程式如下:N2(g)+3H2O(1)═2NH3(g)+$\frac{3}{2}$O2(g);△H=+765.2kJ•mol-1,请在坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3. | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 与水和酒精等混溶 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 与水和酒精等混溶 |
| A. | 蒸馏法 | B. | 萃取法 | ||
| C. | “溶解、结晶、过滤”的方法 | D. | 分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com