
【题目】H2S废气资源化的原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1,如图为H2S燃料电池示意图。下列说法正确的是( )

A.电极a为电池的正极
B.电极b上发生的电极反应为:O2+4H++4e-=2H2O
C.电路中每流过4 mol电子,电池会产生632 kJ热能
D.22.4 L H2S参与反应时,2 mol H+经质子交换膜进入正极区
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A.2a=b<0B.b>d>0C.a<c<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新药H的一种合成路线如图:
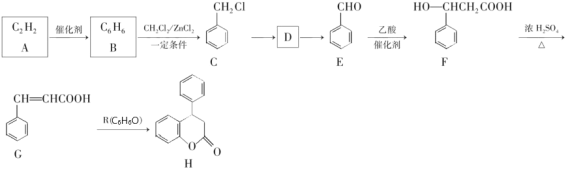
已知:A能使溴水褪色,R遇氯化铁溶液发生显色反应。
(1)R的名称是____________________;G中所含官能团名称是______________。
(2)C→D的反应条件和试剂是____________;E→F的反应类型是___________。
(3)能检验H含酯基的仪器名称是_________。A→B的原子利用率为___________。
(4)写出D→E的化学方程式:____________。
(5)在G的同分异构体中,同时满足下列条件的同分异构体有_______种。
①属于苯的衍生物;
②能发生水解反应和银镜反应;
③能与溴的四氯化碳溶液发生加成反应。
(6)参照上述合成路线,设计一条由乙烯、乙酸为原料制备![]() 的合成路线__________
的合成路线__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入lmolX和2molY,发生下列反应:X(g)+2Y(g)![]() M(g)+2N(g) △H=akJ/mol(a>0),下列说法中正确的是
M(g)+2N(g) △H=akJ/mol(a>0),下列说法中正确的是
A. 到达平衡状态时,加入催化剂,平衡不移动,反应速率也不会发生改变
B. 反应达到平衡时,X和Y的转化率相等
C. v正(X)=2v逆(N)时,反应到达平衡状态
D. 到达平衡状态时,反应吸收akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为HOOC![]() CH2—COOH,下列说法正确的是
CH2—COOH,下列说法正确的是
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1mol苹果酸可与3mol NaOH发生中和反应
C. 1mol苹果酸与足量金属Na反应生成生成1mol H2
D. HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列五种有机物:①CH4、②CH2=CH2、③CH3CH2OH、④ CH3 CH2CH2 CH3 、⑤CH3COOH
请回答:
(1)写出⑤的官能团的名称______。
(2)与①互为同系物的是______(填序号)。
(3)写出④ 的同分异构体的结构简式________________。
(4)写出与②发生加成反应生成乙烷的化学方程式_________________________。
(5)③与⑤发生反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是有机物R 的结构简式,它可用于生产 S﹣诱抗素,下列关于R 的说法正确的是
( )

A.R 结构中含手性碳原子数多于 1 个
B.R 可以在酸性条件下充分水解生成两种有机产物
C.R 可以发生氧化、取代、加聚、缩聚反应,并能与盐酸反应生成有机盐
D.1 mol R 分别与足量NaOH 溶液、足量溴水反应,最多消耗 4 mol NaOH 和 5 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
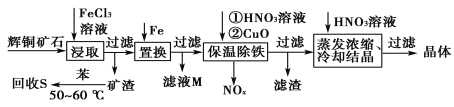
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
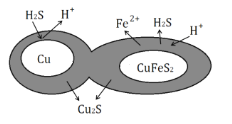
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com