
部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是
A. 滤液A中的阳离子为Fe2+、Fe3+、H+ B.V=224
C.样品中CuO的质量为4.0g D. V=448
D
【解析】
试题分析:合金中,m(Cu)=3.2g,n(Fe)=3.2g/160g·mol-1×2=0.04mol,m(Fe)=0.04mol×56g·mol-1=2.24g,m(O)=5.76 g-3.2g-2.24g=0.32g,n(O)=0.32g/16g·mol-1=0.02mol,由合金中铁由0价变成+2价失去电子的总物质的量等于氧气氧化部分合金得到电子的物质的量与H+反应变成H2得到电子的物质的量之和,得n(H2)×2+n(O)×2=n(Fe)×2,即n(H2)×2+0.02mol×2=0.04mol×2,解得n(H2)=0.02mol,V(H2)=448mL,故D项正确,B项错;有滤渣,滤液A中不存在Fe3+,A项错;样品中氧元素的物质的量总共0.02mol,CuO的物质的量最多0.02mol,质量最大0.02mol×80 g·mol-1=1.6g,C项错。答案选D。
考点:化学计算
点评:本题属于金属与酸反应的计算,综合性强,很锻炼学生的逻辑思维能力,难度较大。


科目:高中化学 来源: 题型:
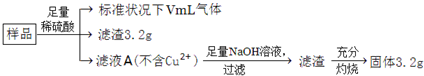
| A、滤液A中阳离子为Fe2+、H+ | B、样品中金属Fe的质量为2.24g | C、样品中CuO的质量为4.0g | D、V=448 |
查看答案和解析>>
科目:高中化学 来源:2010年江苏省扬州市高三第四次模拟考试化学试题 题型:选择题
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+ B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g D.V=448
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com