
| A. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| B. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA | |
| C. | 25℃,1.01×105Pa,11.2L Cl2含有的分子数小于0.5NA | |
| D. | 常温下,23 g NO2含有2NA个氧原子 |
分析 A.氢氧化铁胶粒为氢氧化铁的聚集体;
B.缺少溶液体积,无法计算含有氯离子的数目;
C.常温常压下的气体摩尔体积大于22.4L/mol,则11.2L氯气的物质的量小于0.5mol;
D.根据n=$\frac{m}{M}$计算出二氧化氮的物质的量,然后计算出含有氧原子的物质的量及数目.
解答 解:A.由于氢氧化铁胶粒为氢氧化铁的聚集体,则1molFeCl3与沸水反应生成Fe(OH)3胶粒的数目小于NA个,故A错误;
B.没有告诉氯化镁溶液的体积,无法计算溶液中含有氯离子的物质的量,故B错误;
C.25℃,1.01×105Pa的温度大于标准状况下,该条件下的气体摩尔体积大于22.4L/mol,11.2L氯气的物质的量小于$\frac{11.2L}{22.4L/mol}$=0.5mol,则含有的氯气分子数小于0.5NA,故C正确;
D.23g二氧化氮的物质的量为:$\frac{23g}{46g/mol}$=0.5mol,含有氧原子的物质的量为:0.5mol×2=1mol,含有NA个氧原子,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,C为易错点,注意常温常压的气体摩尔体积大于22.4L/mol,试题培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类 | |
| B. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 | |
| C. | 根据分散剂粒子的大小,将分散系分为溶液、浊液和胶体 | |
| D. | 根据纯净物的元素组成,将纯净物分为单质和化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH=Na++OH- | B. | Na2SO4=2Na++SO4-2 | ||
| C. | H2SO4=H2++SO42- | D. | Ca(NO3)2=Ca2++2(NO3)2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g/mol | B. | 60 g/mol | C. | 90g/mol | D. | 120 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
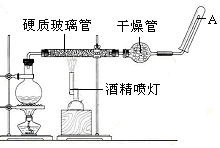 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称是2,5,5-三甲基-3-乙基-庚烷
的名称是2,5,5-三甲基-3-乙基-庚烷 .
. .
.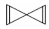 D.
D. 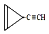 ,其中A、B是链状分子(不考虑这些结构能否稳定存在),请写出所有碳原子均共线的一种链状分子的结构简式:CH≡C-C≡C-CH3.
,其中A、B是链状分子(不考虑这些结构能否稳定存在),请写出所有碳原子均共线的一种链状分子的结构简式:CH≡C-C≡C-CH3.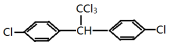 分子中最多有23个原子共面.
分子中最多有23个原子共面.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com