
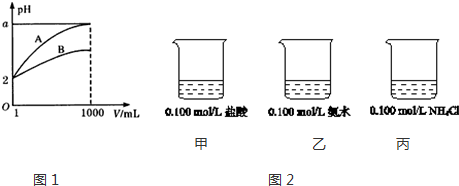
分析 图1.
(1)pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,如果酸是强酸,则稀释后溶液中氢离子浓度为10-5 mol/L,溶液的pH=5,如果pH<5,说明存在电离平衡,为弱酸;
(2)加水稀释促进弱酸电离,稀释后氢离子浓度减小但小于原来的$\frac{1}{1000}$;
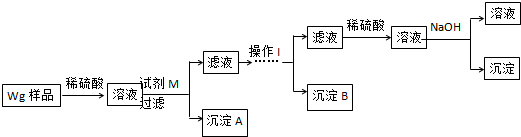
图2.
(1)甲中HCl是强电解质,完全电离,氢离子浓度为0.01mol/L,根据pH=-lgc(H+)计算;
(2)甲和乙混合,二者恰好完全反应生成氯化铵,溶液体积增大一倍,所以混合后溶液中氯化铵浓度是丙中的一半;
(3)若将乙溶液全部倒入丙中,所得的混合溶液pH>7,说明一水合氨电离程度大于铵根离子水解程度导致溶液呈碱性,再结合电荷守恒判断离子浓度大小.
解答 解:(1)稀释弱酸时促进弱酸电离,则稀释过程中pH变化越大的酸的酸性越强,变化越小的酸性越弱,根据图象知,A是强酸、B是弱酸,若再稀释100倍,酸溶液仍然呈酸性,但接近中性,所以A的pH<7,
故答案为:强;弱;<;
(2)若A、B都是弱酸,加水稀释促进弱酸电离,所以稀释1000倍后,溶液中氢离子浓度大于原来的$\frac{1}{1000}$,所以该溶液的pH范围为:2<a<5,故答案为:2<a<5.
图2.
(1)甲中HCl是强电解质,完全电离,氢离子浓度为0.01mol/L,pH=-lgc(H+)=-lg0.1=1,
故答案为:1;
(2)甲和乙混合,二者恰好完全反应生成氯化铵,溶液体积增大一倍,所以混合后溶液中氯化铵浓度是丙中的一半,故答案为:<;
(3)若将乙溶液全部倒入丙中,所得的混合溶液pH>7,说明一水合氨电离程度大于铵根离子水解程度导致溶液呈碱性,c(OH-)>c(H+),结合电荷守恒得c(NH4+)>c(Cl-),一水合氨电离和铵根离子水解程度都较小,所以离子浓度大小顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+),故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+).
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生分析及识图能力,明确弱电解质电离特点及盐类水解特点是解本题关键,注意守恒思想的灵活运用,易错点是图2中(2)题,二者混合导致溶液体积增大溶液的浓度降低,易忽略而导致错误.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 3-氯戊烷的分子式为C6H9Cl3 | B. | 3-氯戊烷属于烷烃 | ||
| C. | 3-氯戊烷的一溴代物共有3种 | D. | 3-氯戊烷的同分异构体共有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)减小 | |
| C. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 稀释后溶液pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质NaCl固体的质量为11.7g. (2)称量:用托盘天平称取所需NaCl固体. (3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水搅拌. (4)转移、洗涤:将烧杯中的溶液注入容量瓶中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶中. (5)定容:将蒸馏水注入仪器至液面离刻度线1~2cm时,改用 胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (7)某同学在实验步骤(6)后,发现凹液面低于刻度线,于是再向容器中滴加蒸馏水至刻度线,该同学所配置溶液是浓度< (填“>”、“=”或“<”)2.00mol/L. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | 0.1mol•L-1的醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 | |
| D. | 0.1mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
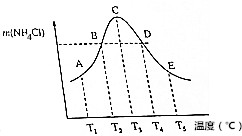 ( )
( )| A. | 不同温度下的平衡常数K3<K4<K5 | |
| B. | 正反应速率:vB=vD | |
| C. | 当体系气体的平均相对分子质量不再改变时,不能说明反应达到平衡状态 | |
| D. | A、B、D、E点均未达到平衡状态,C点达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com