
����Ŀ��һ�ֹ�ҵ�Ʊ�SrCl2��6H2O��������������ͼ��ʾ��

��֪����M(SrCl2��6H2O)��267 g/mol��
��Ksp(SrSO4)��3.3��10��7��Ksp(BaSO4)��1.1��10��10��
�۾������ȡ����Һ����Sr2����Cl��������Ba2����
(1)�����������±��գ���2 mol SrSO4��ֻ��S����ԭ��ת����16 mol���ӡ�д���÷�Ӧ�Ļ�ѧ����ʽ��______________________________ ��
(2)����2����������������_____��_____��
(3)����������Һ��Ŀ����_____��Ϊ�����ԭ�ϵ������ʣ���Һ��Sr2����Ũ��Ӧ������_____ mol/L(ע����ʱ��Һ��Ba2��Ũ��Ϊ1��10��5 mol/L)��
(4)��Ʒ���ȼ�⣺��ȡ1.000 g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO3 1.100��10��2 mol��AgNO3��Һ(��Һ�г�Cl���⣬����������Ag����Ӧ������)����Cl����ȫ�������ú�Fe3������Һ��ָʾ������0.2000 mol/L��NH4SCN����Һ�ζ�ʣ���AgNO3��ʹʣ���Ag�� ��AgSCN��ɫ��������ʽ������
�ٵζ���Ӧ�ﵽ�յ��������_____��
�����ζ�������ȥ����Ũ�ȵ�NH4SCN��Һ20.00 mL�����Ʒ��SrCl2��6H2O�������ٷֺ���Ϊ_____��
���𰸡�SrSO4��4C![]() SrS��4CO��ϴ�Ӹ����ȥBa2��0.03�������һ�α���Һ����Һ��Ϊ��ɫ����30s����ɫ93.45%
SrS��4CO��ϴ�Ӹ����ȥBa2��0.03�������һ�α���Һ����Һ��Ϊ��ɫ����30s����ɫ93.45%
��������
��1��2molSrSO4��ֻ��S����ԭ���Լ�ת�Ƶ������ʵ���Ϊ16mol��S�仯�ļ�̬Ϊ16/2=8mol����S����ԭ�ɵļ�̬Ϊ��2�ۣ�����װ��ͼ������������ʱ����CO�������Ļ�ѧ��Ӧ����ʽΪSrSO4��4C![]() SrS��4CO����
SrS��4CO����
��2����Һ�еõ���ˮ���Ȼ�����Ҫ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ������˻���Ҫ�����IJ�����ϴ�Ӻ��
��3����������ۣ��������ȡ����Һ����Sr2����Cl��������������Ba2������˼���������H2SO4��Ŀ���dz�ȥ����Ba2������ҺBa2��Ũ��Ϊ1��10��5mol��L��1������Һ��c(SO42��)=Ksp(BaSO4)/c(Ba2��)=1.1��10��10/1��10��5mol��L��1=1.1��10��5mol��L��1��ʵ���Ʊ�SrCl2����˾����ܼ���Sr2������ʧ��SrSO4���Ϊ������Һ�������Һ��Sr2����Ũ�Ȳ����ڣ�c(Sr2��)=Ksp(SrSO4)/c(SO42��)=3.3��10��7/1.1��10��5mol��L��1=0.03mol��L��1��
��4���ٸ������⣬��NH4SCN�ζ�����Ag������Fe3����ָʾ������˵ζ���Ӧ�ﵽ�յ�������ǵ������һ��NH4SCN��Һ����Һ��Ϊ(Ѫ)��ɫ����30s����ɫ��
��NH4SCN��AgNO3������Ӧ��NH4SCN��AgNO3=AgSCN����NH4NO3��������Ag�����ʵ���Ϊ20.00��10��3��0.2mol=4��10��3mol��SrCl2��AgNO3������Ӧ���ӷ���ʽΪCl����Ag��=AgCl������ʱ���ĵ�Ag�������ʵ���Ϊ(1.1��10��2��4��10��3)mol=7��10��3mol��SrCl2��2H2O��2Cl����2Ag����m(SrCl2��2H2O)=7��10��3��267/2g=0.9345g������������Ϊ0.9345/1��100%=93.45%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Һϳ����������IJ������£���Բ����ƿ�ڼ����Ҵ���Ũ��������ᣬƿ����ֱ��װͨ����ȴˮ��������(ʹ��Ӧ��������������ΪҺ��������ƿ��)�����Ȼ���һ��ʱ�������װ�ý�������(����ͼ��ʾ)���õ������Ҵ��������ˮ�����������ֲ�Ʒ��(��֪���Ҵ������ᡢ���������ķе�������78.4 �桢118 �桢77.1 ��)��

������������ȡװ��
��ش��������⣺
(1)����ƿ�г��˼����Ҵ���Ũ����������⣬��Ӧ���뼸�����Ƭ����Ŀ����_______________��
(2)����ƿ�м���һ���������Ҵ���Ũ����Ļ��Һ�ķ�����__________��
(3)����1 mol�Ҵ���1 mol ������Ũ���������¼��ȣ���ַ�Ӧ���ܷ�________(��ܻ��ܡ�)����1mol������������ԭ����___________��
(4)��Ӧ��ʼʱ�þƾ��ƶ�Բ����ƿС����ȵ�ԭ����___________________________��
(5)������ƿ����������������̼������Һ�IJ���Ϊ(ֻ������)__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������H2��ԭSiHCl3���е㣺31.85�����Ʊ������װ����ͼ��ʾ���г�װ�ú�β������װ����ȥ��,����˵����ȷ���ǣ� ��

A. װ����������ʢװ����ŨH2SO4����ˮ
B. ʵ��ʱ��Ӧ�ȼ��ȹ�ʽ¯���ٴ�ʢװϡ����ķ�Һ©��
C. Ϊ�����ƵõĹ����Ƿ��������ʣ���Ҫ�õ����Լ�Ϊ���ᡢ˫��ˮ�����軯����Һ
D. ��ʵ�����Ʊ�������װ��Ҳ��������������ϡ��Һ���Ȼ�粒��巴Ӧ�Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��![]() �ں��º����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��
�ں��º����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��
![]() ��λʱ��������n
��λʱ��������n![]() ��ͬʱ����2n
��ͬʱ����2n![]() ��
��
![]() ��λʱ��������n
��λʱ��������n![]() ��ͬʱ����2nmolNO��
��ͬʱ����2nmolNO��
![]() ����������ɫ���ٸı��״̬��
����������ɫ���ٸı��״̬��
![]() ���������
���������![]() ���䣻
���䣻
![]() ������������NO������������ȣ�
������������NO������������ȣ�
![]() ������ѹǿ����ʱ��仯���仯��
������ѹǿ����ʱ��仯���仯��
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����������ԭ����������
A. 64 g SO2 B. 3.01��1023��N2
C. 0.75 mol H2S D. 36 mL H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¶��£�0.1molN2(g)��0.3molH2(g)���ܱ������з�����Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H=-akJ��mol-1(a>0)������˵����ȷ����
2NH3(g) ��H=-akJ��mol-1(a>0)������˵����ȷ����
A. �ﵽ��ѧƽ��״̬ʱ����Ӧ�ų�0.la kJ����
B. �ﵽ��ѧƽ��״̬ʱ��v��(NH3)��v��(N2)=2��1
C. n( N2)��n(H2)��n(NH3)=l��3��2ʱ��˵���÷�Ӧ�ﵽƽ��
D. ��С����������õ�����ʾ�ķ�Ӧ���ʣ�v��(N2)����v��(N2)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���Ӧ��N2(g��+3H2(g��![]() 2NH3(g����H=-92.4kJmol-1���ڷ�Ӧ�����У�����Ӧ���ʵı仯��ͼ������˵����ȷ��������
2NH3(g����H=-92.4kJmol-1���ڷ�Ӧ�����У�����Ӧ���ʵı仯��ͼ������˵����ȷ��������
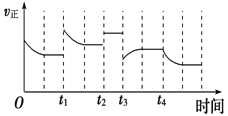
A. t1ʱ������������Ũ��
B. t2ʱʹ���˴���
C. t3ʱ������ѹǿ
D. t4ʱ�������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�Fe(OH)3(s)��Cu(OH)2(s)�ֱ�����Һ�дﵽ�����ܽ�ƽ��ı���ҺpH������������Ũ�ȱ仯��ͼ��ʾ����ͼ�����������ж���ȷ����

A. [Ksp[Cu(OH)2]<Ksp[Fe(OH)3]
B. d���������Һ��Fe(OH)3�ѹ����͡�Cu(OH)2δ����
C. ������NH4Cl�����ʹ��Һ��a��䵽b��
D. b��c���������Fe(OH)3��Cu(OH)2�ܽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ�飬װ�ú������ܴﵽʵ��Ŀ�ĵ���

A. װ�â٣����Ȼ�狀�����������NH3 B. װ�âڣ��ռ�NO����
C. װ�âۣ��ӱ���ʳ��ˮ����ȡ�Ȼ��� D. װ�âܣ�̽�������ԣ�KMnO4��Cl2��I2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com