
| 催化剂 |
| 催化剂 |
| 温度CO2% n(H2)/n(CO2) | 500K | 600K | 700K | 800K |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
| n(H2) |
| n(CO2) |
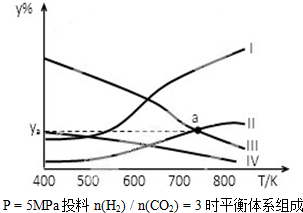 ①表示CH3CH2OH体积分数曲线的是
①表示CH3CH2OH体积分数曲线的是| 1 |
| 2 |
| c(CH3CH2OH)?c3(H2O) |
| c2(CO2)?c6(H2) |
| n(H2) |
| n(CO2) |
| c(CH3CH2OH)?c3(H2O) |
| c2(CO2)?c6(H2) |
| 3x |
| 1-2x+3-6x+x+3x |
| 3x |
| 4-4x |
| 3×0.2 |
| 4-4×0.2 |


科目:高中化学 来源: 题型:
| A、Fe2+、K+、ClO-、Cl- |
| B、Ag+、Na+、Cl-、NO3- |
| C、NH4+、K+、CO32-、Br- |
| D、H+、Ca2+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
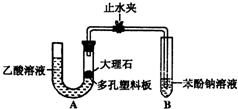 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验. -ONa溶液的pH,其pH由大到小排列的顺序为
-ONa溶液的pH,其pH由大到小排列的顺序为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+6H+=3I2+3H2O |
| B、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| C、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| D、钠与水的反应:Na+H2O=Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 如图装置可测定反应速率 |
B、 用如图装置制备Fe(OH)2 |
C、 用如图装置制取少量金属锰 |
D、 实验室用如图所示装置制取少量氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B、氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C、向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D、粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com