
 如图:如图:通电5min后,电极5质量增加2.16g,试回答:
如图:如图:通电5min后,电极5质量增加2.16g,试回答:| 2.16g |
| 108g/mol |
| 0.02mol |
| 4 |
| 0.112L |
| 22.4L/mol |
| 0.01mol |
| 2 |
| 0.005mol |
| 0.2L |
| ||
| ||
| 0.02mol |
| 0.2L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:物理教研室 题型:022

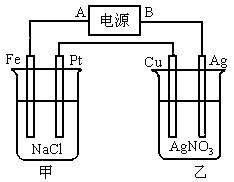
(1)A点是电源的________极,Ag极是乙装置的________极;
(2)写出甲池中Pt电极反应式:________________________,写出乙池中Cu电极反应式:________________________;
(3)若在电解中Ag电极质量减轻了5.4g,则在Fe电极生成________g气体,Pt电极生成________L气体(标准状况),Cu电极增重________g,乙池中AgNO3溶液的浓度________。(填“增大”、“减少”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:022
如右图装置,该装置通电5min后,向甲池两极分别滴入酚酞试液,发现铁电极附近溶液变红。回答下列问题:

(1)A点是电源的________极,Ag极是乙装置的________极;
(2)写出甲池中Pt电极反应式:________________________,写出乙池中Cu电极反应式:________________________;
(3)若在电解中Ag电极质量减轻了5.4g,则在Fe电极生成________g气体,Pt电极生成________L气体(标准状况),Cu电极增重________g,乙池中AgNO3溶液的浓度________。(填“增大”、“减少”或“不变”)
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1)A点是电源的________极,Ag极是乙装置的________极;
(2)写出甲池中Pt电极反应式:________________________,写出乙池中Cu电极反应式:________________________;
(3)若在电解中Ag电极质量减轻了5.4g,则在Fe电极生成________g气体,Pt电极生成________L气体(标准状况),Cu电极增重________g,乙池中AgNO3溶液的浓度________。(填“增大”、“减少”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
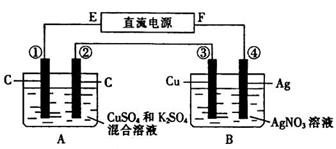 如图所示装置,通电 5min 后,第 ③ 极增重2.16 g ,同时在 A 池中收集到224 mL气体(标准状况下)。
如图所示装置,通电 5min 后,第 ③ 极增重2.16 g ,同时在 A 池中收集到224 mL气体(标准状况下)。
请回答下列问题:
⑴ E为 极;
⑵ 第 ② 极上产生的气体是 ,物质的量
为 ;
⑶ 写出第 ① 极上发生反应的电极反应式:
;
⑷ 设A池中原混合液的体积为200mL ,则通电前A池中原混合液中Cu2+的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置,通电 5min 后,第 ③ 极增重2.16 g ,同时在 A 池中收集到224 mL气体(标准状况下)。
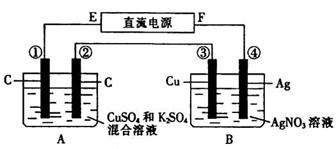
请回答下列问题:
⑴ E为 极;
⑵ 第 ② 极上产生的气体是 ,物质的量为 ;
⑶ 写出第 ① 极上发生反应的电极反应式: ;
⑷ 设A池中原混合液的体积为200mL ,则通电前A池中原混合液中Cu2+的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com