
【题目】“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质:①是溶液 ②是胶体 ③具有丁达尔现象 ④不能透过半透膜 ⑤不能透过滤纸⑥静止后会出现黑色沉淀。其中正确的是
A. ①④⑥ B. ②③⑤ C. ②③④ D. ①③④⑥
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是__________,该装置中发生反应的化学方程式为_________________________。
(2)实验过程中,装置乙、丙中出现的现象分别是:____________________、____________________;装置丙中的试管内发生反应的离子方程式为:_____________________。
(3)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为__________色,为了证明铁元素在该反应中的产物可以____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠在供氧、防腐、除臭、微量分析等多方面有着重要用途,工业生产过氧化钠的方法是将除去二氧化碳且干燥后的空气通入熔融的钠(温度180~200℃)中得到氧化钠,然后增加空气流量并迅速升高温度至300~400℃即可得到过氧化钠。某化学兴趣小组模拟工业流程制备过氧化钠的装置如图所示。

请回答下列相关问题。
(1)浓硫酸的作用是______________。
(2)升温至300~400℃时发生主要反应的化学方程式是______________。
(3)下列选项中的加热方式适合该实验的是_____(填字母)。
A.水浴 B.油裕(100~260℃) C.控温电炉(150~500℃) D.酒精喷灯(1000~1200℃)
(4)若要提高产品纯度,需在具支试管后添加一个装置,该装置应该是________。
(5)在具支试管后添加(4)中所要求的装置后,某同学还认为制得的过氧化钠中还含有少量的某种杂质,该杂质是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示500℃时,X、Y、Z三种气体在容积固定的容器中反应,各物质的浓度随时间的变化情况.达到平衡后,改变压强,平衡不移动.下列说法中正确的是( ) 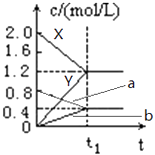
A.Z物质的变化情况为曲线b
B.该反应的化学方程式为:2X(g)3Y(g)+Z(g)
C.0→t1 , X的物质的量浓度变化量为1.2mol/L
D.若t1=1min,则v(Y )=0.02molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)
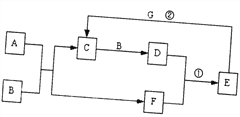
请回答下列问题:
(1)A、C的化学式分别为_______、_______。
(2)反应①的化学方程式为_______。
(3)反应②的离子方程式为_______。
(4)向反应②后的溶液中通入少量的A,现象为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中因含有机物而具有较高的化学耗氧量.常用酸性KMnO4氧化有机物测其含量.主要操作步骤如下: 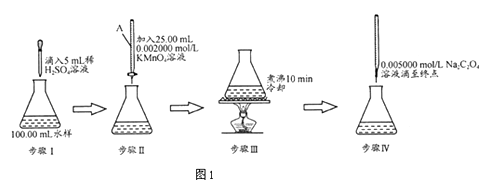
(1)仪器A为(填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为;
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42﹣+MnO4﹣+H+═Mn2++CO2↑+;
该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00mL,已知滴定后的液面如图所示,请在图2中标出滴定前的液面. 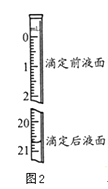
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl﹣影响
猜想2:配制Na2C2O4标液定容时;
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl﹣影响.(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) .
资料卡片:
①有机质可HNO3被氧化
②AgCl不与酸性KMnO4溶液反应
③Ag2C2O4可被酸性KMnO4溶液氧化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于制取、干燥NH3、验证NH3还原性、吸收过量NH3并防止倒吸,其中能达到实验目的的是
A. 制取NH3  B. 干燥NH3
B. 干燥NH3 
C. 验证还原性 D. 吸收尾气
D. 吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测和处理.某工厂对制铬工业污泥中Cr(Ⅲ)的回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+ , 其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+): 
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0 溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是(至少一条).
(2)调pH=4.0是为了除去
(3)钠离子交换树脂的作用原理为Mn++nNaR→MRn+nNa+ , 被交换的杂质离子是
(4)试配平下列氧化还原反应方程式:Fe2++H2O2+H+═Fe3++
(5)通入SO2的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答下列问题:
(1)写出元素E在周期表中的位置:;判断物质X中存在的化学键类型 .
(2)C、D、E分别形成的简单离子半径由大到小的顺序是:(用离子符号表示);C、E氢化物的热稳定性比较(用具体物质化学式比较).
(3)B元素的氢化物可以在实验室中制取, 
①写出B元素氢化物的电子式,其实验室发生装置可以选择如图中的 , 常用的实验室制备反应的化学方程式为 .
②欲制备并收集一瓶干燥的该气体,选择如图中的装置,其连接顺序为:(按气流方向,用导管口字母表示) .
③欲证明上述盐X溶液中含有的阳离子,其方法是 .
(4)E的最高价态与A、B、C三种元素形成的酸式盐Y在水溶液中的电离方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com