
分析 相同条件下,酸的电离平衡常数越大,其电离程度越大,则酸根离子的水解程度越大,溶液的碱性越强;
草酸:H2C2O4,K1=5.9×10-2第一步电离大于碳酸:H2CO3,K1=4.3×10-7,
草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中[H+]>[HC2O4-]>[C2O42-]>[HCO3-]>[CO32.
解答 解:草酸的第二步电离平衡常数大于碳酸的第二步电离平衡常数,电离平衡常数越小,其酸根离子的水解程度越大,所以碳酸根离子的水解程度大于草酸根离子,0.1mol/L Na2CO3溶液的pH大于0.1mol/L Na2C2O4溶液的pH,
草酸的酸性强于碳酸,则等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸,
草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中[H+]>[HC2O4-]>[C2O42-]>[HCO3-]>[CO32-],则ac正确,bd错误.
故答案为:大于;草酸; ac.
点评 本题考查较为综合,涉及电离平衡常数、离子浓度大小比较以及弱电解质的电离等知识,为高考常见题型和高频考点,侧重于学生的分析、计算能力的考查,注意把握平衡常数的意义以及离子浓度大小比较方法,题目难度中等.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
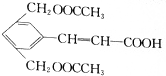 )在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C.回答下列问题:
)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C.回答下列问题: CH3COOCH2CH3+H2O,该反应的反应类型是酯化(取代)反应
CH3COOCH2CH3+H2O,该反应的反应类型是酯化(取代)反应 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸遇明火爆炸 | |
| B. | 浓硫酸遇水发热爆炸 | |
| C. | 铁与水反应产生的氢气接触空气遇明火爆炸 | |
| D. | 稀释后的硫酸与铁反应产生的氢气接触空气遇明火爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度 | B. | 混合气体的压强 | ||
| C. | 混合气体的平均摩尔质量 | D. | SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+ | B. | Al3+ | C. | Fe2+、Al3+ | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
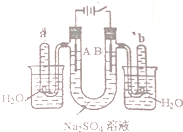 如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )
如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )| A. | 逸出气体的体积,A电极的小于B电极的 | |
| B. | 一电极逸出无味气体,另一电极逸出刺激性气味气体 | |
| C. | A电极附近呈红色,B电极附近呈蓝色 | |
| D. | 电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气象环境报告中的“PM2.5”是对一种新分子的描述 | |
| B. | 长期使用硫酸铵(NH4)2SO4化肥会使土壤酸化 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com