
【题目】气体A是一种三原子分子,某学习小组按下列流程进行了实验:
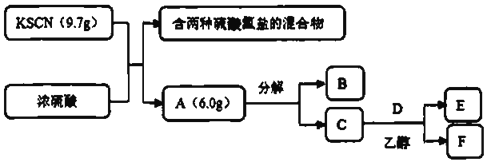
其中,将金属钠投入足量的无水乙醇,往反应液中通人![]() ,可制得D,C和D按
,可制得D,C和D按![]() 反应生成等物质的量的E和F.已知:B是一种常见的氧化物;C是一种淡黄色的固体单质;E在标准状况下的密度约为
反应生成等物质的量的E和F.已知:B是一种常见的氧化物;C是一种淡黄色的固体单质;E在标准状况下的密度约为![]() 。请回答:
。请回答:
(1)A的结构_______________,其空间构型为_______________。
(2)KSCN粉末与浓硫酸反应生成A的化学方程式_________________;为检验硫酸氢盐混合物中的![]() ,请写出实验操作和现象______________________________。
,请写出实验操作和现象______________________________。
(3)A不太稳定,容易分解,写出A分解为B和C的化学方程式________________________。
(4)①D的化学式________________。
②F的成键情况与![]() 相似,F的电子式________________。
相似,F的电子式________________。
③工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH.试写出电解熔融NaOH的化学方程:________________。
【答案】O=C=S 直线型 ![]() 将少量混合物加入过量得NaOH溶液微热,产生的气体能使湿润的红色石蕊试纸变蓝则证明存在
将少量混合物加入过量得NaOH溶液微热,产生的气体能使湿润的红色石蕊试纸变蓝则证明存在![]()
![]() NaHS
NaHS ![]()
![]()
【解析】
由流程图可知浓硫酸与硫氰化钾反应生成两种硫酸氢盐和一种三原子物质A,则硫酸氢盐只可能是![]() ,再根据质量守恒可知方式为:
,再根据质量守恒可知方式为:![]() ;C是一种淡黄色的固体单质,则C为S,B 是一种常见的氧化物则B为CO,E在标准状况下的密度约为
;C是一种淡黄色的固体单质,则C为S,B 是一种常见的氧化物则B为CO,E在标准状况下的密度约为![]() ,则E的摩尔质量
,则E的摩尔质量![]() ,则E为H2S,将金属钠投入足量的无水乙醇,往反应液中通人
,则E为H2S,将金属钠投入足量的无水乙醇,往反应液中通人![]() ,可制得D,C和D按
,可制得D,C和D按![]() 反应生成等物质的量的E和F,则D为NaHS;由反应可知
反应生成等物质的量的E和F,则D为NaHS;由反应可知![]() ,F为
,F为![]() ,据此回答。
,据此回答。
由流程图可知浓硫酸与硫氰化钾反应生成两种硫酸氢盐和一种三原子物质A,则硫酸氢盐只可能是![]() ,再根据质量守恒可知方式为:
,再根据质量守恒可知方式为:![]() ;C是一种淡黄色的固体单质,则C为S,B 是一种常见的氧化物则B为CO,E在标准状况下的密度约为
;C是一种淡黄色的固体单质,则C为S,B 是一种常见的氧化物则B为CO,E在标准状况下的密度约为![]() ,则E的摩尔质量
,则E的摩尔质量![]() ,则E为H2S,将金属钠投入足量的无水乙醇,往反应液中通人
,则E为H2S,将金属钠投入足量的无水乙醇,往反应液中通人![]() ,可制得D,C和D按
,可制得D,C和D按![]() 反应生成等物质的量的E和F,则D为NaHS;由反应可知
反应生成等物质的量的E和F,则D为NaHS;由反应可知![]() ,F为
,F为![]() 。
。
(1)A的结构为O=C=S,与二氧化碳类似为直线型结构,故答案为:O=C=S;直线型;
(2)KSCN粉末与浓硫酸反应成A的化学方程式![]() ;检验
;检验![]() 可用NaOH和红色石蕊试纸,操作为:将少量混合物加入过量得NaOH溶液微热,产生的气体能使红色石蕊试纸变蓝则证明存在
可用NaOH和红色石蕊试纸,操作为:将少量混合物加入过量得NaOH溶液微热,产生的气体能使红色石蕊试纸变蓝则证明存在![]() ,故答案为:
,故答案为:![]() ;将少量混合物加入过量的NaOH溶液微热,产生的气体能使湿润的红色石蕊试纸变蓝则证明存在
;将少量混合物加入过量的NaOH溶液微热,产生的气体能使湿润的红色石蕊试纸变蓝则证明存在![]() ;
;
(3)A分解为B和C的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)D的化学式为NaHS;F的化学是为![]() ,电子式为
,电子式为![]() ;电解熔融NaOH的化学方程:
;电解熔融NaOH的化学方程:![]() ,故答案为:NaHS;
,故答案为:NaHS;![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值为1:1 ⑦混合气体总质量 ⑧混合气体总体积
A. ①②③④⑤⑥⑦⑧B. ①③④⑤C. ①②③④⑤⑦D. ①③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量
的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与
所加盐酸体积之间关系如下图所示。下列判断正确的是
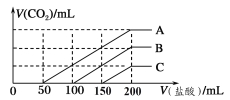
A.通入CO2后,A烧杯中的溶质成分是Na2CO3
B.B烧杯中通入的CO2体积为448 mL
C.原NaOH溶液的浓度为0.2 mol/L
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.2C8H18(l)+25O2(g)![]() 16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol(燃烧热)
16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ΔH=+57.3kJ/mol(中和热)
NaCl(aq)+H2O(l) ΔH=+57.3kJ/mol(中和热)
C.S(s)+O2(g)![]() SO2(g) ΔH=269.8kJ/mol(反应热)
SO2(g) ΔH=269.8kJ/mol(反应热)
D.Fe+S![]() FeS ΔH=95.6kJ/mol(反应热)
FeS ΔH=95.6kJ/mol(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:请回答下列问题:
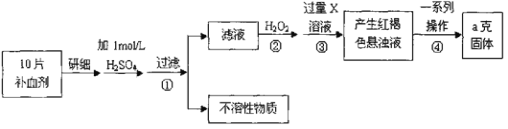
(1)实验中碾碎药片需要的仪器是_____________。
A.烧杯 B.研钵 C.坩埚
(2)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加____________,该过程的现象为:__________________________________________________________。
(3)步骤②加入过量H2O2的目的:________________________________________。
(4)步骤②③中反应的离子方程式:②________________、③_________________。
(5)步骤④中一系列处理的操作步骤:过滤、___、灼烧、____、称量。
(6)若实验无损耗,则每片补血剂含铁元素的质量_____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制0.500 mol/L的Na2CO3溶液100mL,回答下列问题:
(1)所需主要仪器为:药匙、托盘天平、烧杯、胶头滴管、__________、_______.
(2)本实验须称量碳酸钠晶体(Na2CO310H2O)________g。
(3)①如果定容时仰视会导致溶液浓度__________(填“偏高”、“偏低”或“无影响” 下同);
②容量瓶未经干燥就用来配制该溶液,会导致溶液浓度_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
A.1molNH4+所含电子数为10NA
B..5.6LCO2中含有的分子数为0.25NA
C.1.2gMg与足量稀硫酸反应,转移的电子数为0.1NA
D.常温常压下,32gO2和O3的混合气体所含原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,也是化学实验室里必备的重要试剂。除了具有酸的通性以外,还具有一些特殊的性质。
Ⅰ.镁与稀硝酸的反应为:4Mg+10HNO3(稀)=4Mg(NO3)2+NH4NO3+3H2O
(1)用“双线桥法”表示该反应中电子转移的方向和数目___。
(2)该反应中氧化剂与还原剂的物质的量之比为___。
(3)还原产物是__。
(4)若反应过程中转移的电子数为1.505×1023,则参加反应的Mg的质量为__。
Ⅱ.某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是反应的产物之一。写出反应的化学方程式__(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:在B水槽中装有500 mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL。
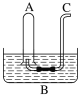
(1)将A倒插入B槽中发生反应的化学方程式为_______________________________________,该反应中氧化剂与还原剂的质量比为________,原混合气体中NO2和NO的物质的量之比为________。
(2)通过导气管C向余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是_______________________________________________________________________。
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为________ mol·L1(设溶液的体积仍为500 mL)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com